
|
||||||||||||||
| Autoren | ∞ | Werke | ∞ | Neu | ∞ | Information | ∞ | Shop | ∞ | Lesetips | ∞ | Textquelle | ∞ | |
Anzeige. Gutenberg Edition 16. 2. vermehrte und verbesserte Auflage. Alle Werke aus dem Projekt Gutenberg-DE. Mit zusätzlichen E-Books. Eine einmalige Bibliothek. +++ Information und Bestellung in unserem Shop +++
Wir wiederholen nun unsern vorigen Versuch von S. 22, indem wir als brennenden Körper eine glühende Kohle nehmen und sie in das trockene Glas hinein halten, wir suchen vergeblich nach dem gewohnten Wasserbeschlag. Es findet also keine Bildung von Wasser bei der Verbrennung der Kohle statt, wenn wir dagegen den gasförmigen Inhalt des Glases mit Hilfe von Kalkwasser in gewohnter Weise untersuchen, so überzeugen wir uns alsbald, daß das Kohlendioxyd, welches das Kalkwasser trübe macht, allerdings beim Verbrennen der Kohle entsteht, wir schließen daraus, daß Wasser und Kohlendioxyd nicht notwendig gleichzeitig bei Verbrennungen entstehen. Wir haben ja beim verbrennenden Eisen auch kein Wasser unter den Verbrennungsprodukten gefunden, wir können uns auch leicht überzeugen, daß kein Kohlendioxyd dabei entsteht, wenn wir Eisen in einem Glase verbrennen lassen und den Inhalt später mit Kalkwasser prüfen, so bleibt der Niederschlag aus, zum Zeichen daß kein Kohlendioxyd vorhanden ist. Auch kann man nachweisen, daß es Verbrennungen gibt, bei denen nur Wasser und kein Kohlendioxyd entsteht. Dazu brauchen wir bloß das bekannte Gas Wasserstoff, das zum Füllen von Luftballons verwendet wird, zu entzünden und das trockene Glas darüber zu halten. Man beobachtet alsdann den Beschlag von Wasserdampf, aber die Prüfung, ob Kohlendioxyd vorhanden ist, gibt ein negatives Ergebnis und ebensowenig findet man irgendeinen andern Stoff als Produkt der Verbrennung des Wasserstoffs vor.
Hier haben wir also Vorgänge kennen gelernt, bei denen das Gewicht der beteiligten Stoffe zunahm, das heißt, bei welchen verschiedenartige Stoffe miteinander sich so veränderten, daß Produkte entstanden, deren Gewicht mehr betrug als das Gewicht jedes der beteiligten Stoffe. Wegen des Gesetzes von der Erhaltung des Gewichtes muß natürlich das Gesamtgewicht hierbei unverändert bleiben. Das heißt, das Gewicht von dem verbrennenden Weingeist oder Eisen oder Öl einerseits und das von dem gleichzeitig verschwundenen Sauerstoff der Luft andererseits kann sich nicht verändert haben. Wohl aber ist dies Gesamtgewicht natürlich größer als einerseits das Gewicht des Sauerstoffs und andrerseits das Gewicht der verbrannten Stoffe einzeln.
Die bisher beschriebenen chemischen Vorgänge waren solche, bei denen mehrere Stoffe verschwanden, indem sie sich untereinander verbanden und ihr Gewicht vermehrten. Es gibt auch umgekehrte chemische Vorgänge, wo nämlich einzelne Stoffe in mehrere auseinander gehen, von denen natürlich jeder einzelne weniger wiegen muß, als die ursprüngliche Substanz wog. Ein Beispiel hierfür liefert uns das bekannte Salz Kaliumchlorat, das unter seinem lateinischen Apothekernamen Kalium chloricum sehr häufig in der Hausmedizin angewendet wird, um kleine Entzündungszustände der Mundhöhle zu beseitigen. Wenn wir etwas von diesem Salze in einem dünnwandigen unten geschlossenen Glasrohre erhitzen, wie es unter dem Namen Probierrohr von den Chemikern benutzt wird, so schmilzt es zunächst zu einer klaren Flüssigkeit. Bei stärkerem Erhitzen scheint diese Flüssigkeit in ein Sieden zu geraten, indem eine große Anzahl von Gasblasen sich aus ihr entwickeln. Es verdichtet sich aber keine Flüssigkeit, wie etwa beim Sieden des Wassers oder Quecksilbers im obern kühlen Teil des Probierrohrs, sondern dies bleibt trocken. Dagegen hat sich ein Gas entwickelt, welches von der gewöhnlichen atmosphärischen Luft verschieden ist. Wir überzeugen uns davon, indem wir einen Holzspan am Ende entzünden und nach einigem Brennen ausblasen, so daß er nur noch glimmt. Tauchen wir diesen glimmenden Spahn in das Innere des Probierröhrchens hinein, so entzündet er sich plötzlich mit starkem Glanze und kann brennend herausgezogen werden. Wenn wir das Erhitzen einige Zeit fortsetzen, so nehmen wir wahr, daß, trotzdem die Temperatur nicht gefallen ist, allmählich die Flüssigkeit erstarrt und ein weißes Salz sich aus ihr absondert, das erst bei sehr hoher Temperatur zum Schmelzen gebracht werden kann. Und haben wir das zum Versuch benutzte Kaliumchlorat vorher gewogen, so können wir uns bald überzeugen, daß es mehr als ein Drittel seines Gewichtes verloren hat.
Hier sehen wir also einen ursprünglich einheitlichen Stoff in zwei verschiedene Stoffe zerfallen, einerseits das Gas, welches die Verbrennung so lebhaft unterhalten hat, und andererseits das andere Salz, dessen Schmelzpunkt so sehr viel höher liegt als der des ursprünglichen Salzes, und das sich auch in seinen übrigen Eigenschaften als durchaus verschieden von jenem erweist.
Einen solchen chemischen Vorgang, bei welchem ein Stoff in mehrere gespalten wird, nennt man eine Zerlegung im Gegensatz zu dem Vorgang der Verbindung, bei welchem aus mehreren Stoffen einer entsteht.
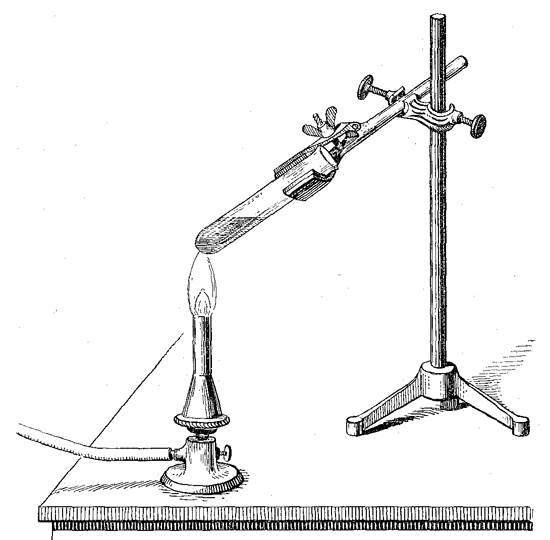
Fig. 3.
Verbindungen und Zerlegungen kann man so gut wie mit allen Stoffen vornehmen. Es gibt für jeden bekannten Stoff (mit sehr wenigen Ausnahmen) eine Anzahl anderer Stoffe, mit denen man ihn so verbinden kann, daß, neue einheitliche Stoffe größeren Gewichtes dabei entstehen, und es gibt eine Anzahl von Stoffen, die man durch geeignete Maßnahmen derart zerlegen kann, daß aus den einheitlichen Stoffen mehrere untereinander verschiedene sich bilden. Dazu diente in dem eben betrachteten Fall die Wärme. Die Elektrizität und mancherlei andere Agenzien können ähnliches bewirken.
Indessen beobachten wir dennoch, daß es einzelne Stoffe gibt, bei denen alle Mittel versagen, aus ihnen einfachere Bestandteile zu gewinnen. Die Anzahl solcher Stoffe hat sich im Lauf der Zeit als ziemlich hoch herausgestellt. Man kennt jetzt etwa achtzig verschiedene Stoffe, welche diese Eigenschaft haben, daß nur solche Vorgänge an ihnen stattfinden, bei denen sie in Verbindungen übergehen, das heißt neue Stoffe von größerem Gewicht durch Zufügung anderer Stoffe bilden. Niemals aber kann man sie derartig umwandeln, daß sie in zwei oder drei oder mehr andere Stoffe zerfallen, von denen jeder einzelne weniger wiegt als der Ausgangsstoff.
Solche Stoffe nennt man unzerlegbare Stoffe oder Elemente.
Obwohl es in der Natur viele Tausende von verschiedenartigen Stoffen gibt, so findet man, wenn man sie genauer untersucht, bei der Zerlegung doch nichts anderes in ihnen als irgendwelche von diesen achtzig Elementen. Dabei liegen die Sachen noch so, daß von den 80 Elementen nur 20 oder 30 einigermaßen häufig in der Natur vorkommen, während alle übrigen, also die größere Mehrzahl, verhältnismäßig selten sind und sich nur in wenigen selten vorkommenden Stoffen antreffen lassen, hauptsächlich in Mineralien, die man an vereinzelten Orten der Erde findet. Also die ganze große Mannigfaltigkeit der verschiedenen Stoffe, die sich überall in der Natur zerstreut vorfinden, die ungeheure Zahl künstlicher Stoffe, die von den wissenschaftlichen und technischen Chemikern in den letzten Jahrzehnten hergestellt worden sind, alle diese vielen Stoffe »bestehen« aus verhältnismäßig wenigen Elementen, das heißt sie wandeln sich bei der Zerlegung in diese verhältnismäßig wenigen Elemente um.