
|
||||||||||||||
| Autoren | ∞ | Werke | ∞ | Neu | ∞ | Information | ∞ | Shop | ∞ | Lesetips | ∞ | Textquelle | ∞ | |
Anzeige. Gutenberg Edition 16. 2. vermehrte und verbesserte Auflage. Alle Werke aus dem Projekt Gutenberg-DE. Mit zusätzlichen E-Books. Eine einmalige Bibliothek. +++ Information und Bestellung in unserem Shop +++
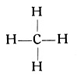
Wir lernten den Kohlenstoff als ein vierwertiges Element kennen und stellten auch bereits fest, daß ein Atom Kohlenstoff sich mit dem Wasserstoff nur in der Weise verbinden kann, daß jede der vier Kohlenstoffvalenzen ein einwertiges Wasserstoffatom bindet. So entsteht die Verbindung CH4, das Methan- oder Sumpfgas:
Es leuchtet wohl auch ein, daß an Stelle des einwertigen Wasserstoffs irgendein anderes einwertiges Element treten kann. Der Chemiker bezeichnet eine solche Stellvertretung oder einen solchen Ersatz als Substitution. So kann man beispielsweise im Methan drei Wasserstoffatome durch drei Atome des ebenfalls einwertigen Chlors ersetzen und erhält dann einen Körper, dessen empirische Formel CHCl3 lautet, während seine Strukturformel wie folgt aussieht:
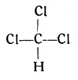
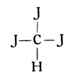
Dieser so entstandene Körper ist nun aber kein Gas mehr, sondern eine betäubende Flüssigkeit und unter dem Namen Chloroform wohl bekannt. An Stelle des einwertigen Chlors kann aber auch das ebenfalls einwertige Jod treten. Geschieht dies für drei Wasserstoffatome des Methans, so haben wir das Jodoform, jenes bekannte gelbe, stark riechende Pulver mit der Strukturformel
Im allgemeinen gilt der Grundsatz, daß in einer chemischen Verbindung irgendein einwertiges Atom immer durch das Atom irgendeines beliebigen anderen einwertigen Elementes ersetzt werden kann. Im Methan können so der Reihe nach alle Wasserstoffatome durch Chloratome ersetzt werden, so daß man schließlich zu einem Stoff von der Formel CCl4 gelangt, dem Tetrachlorkohlenstoff. Die Kunst der modernen Farbstoffchemie besteht zu einem beträchtlichen Teile darin, bei gegebenen Kohlenwasserstoffverbindungen des Steinkohlenteers solche Substitutionen vorzunehmen. Welche einschneidenden Änderungen dabei die Substitution auch nur weniger Atome hervorrufen kann, ergibt sich wohl schon zur Genüge bei der Betrachtung der drei Stoffe: Sumpfgas, Chloroform und Jodoform. In der Teerchemie bewirken diese Substitutionen besonders prächtige Farbenerscheinungen und verwandeln irgendein unscheinbares graues oder weißes Salz im Augenblick in einen leuchtenden Farbstoff. Im Interesse einer guten Übersicht wollen wir im folgenden zunächst von derartigen Substitutionen absehen und nur die Verbindungen des vierwertigen Kohlenstoffs mit dem einwertigen Wasserstoff, die Kohlenwasserstoffe, betrachten.

Fig. 42.
Vorbereitungen zur Herstellung räumlicher Molekülmodelle.
Eine Glasperle mit einer Spitze (Modell eines einwertigen Atoms) soll in Gips abgegossen werden. Eine Zigarrenkiste wird in zwei gleiche Hälften zerschnitten. Ein Krug mit flüssigem Gipsbrei wird vorbereitet.
Fig. 43.
Die beiden Hälften der aufgeschnittenen Zigarrenkiste bilden die Hüllen für die beiden Hälften der Gußform.
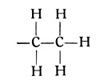
Wir nehmen nun zwei Kohlenstoffatome und wollen versuchen, was sich aus diesen und dem erforderlichen Wasserstoff zusammenbauen läßt. Wenn die beiden Kohlenstoffatome sich je eine Hand reichen, so behält jedes derselben noch drei freie Valenzen; wir können also im ganzen sechs Wasserstoffatome anhängen und erhalten einen Körper von der Formel C2H6. Der so gewonnene Kohlenwasserstoff
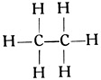
ist ebenfalls ein Gas und als Äthan bekannt. Aber mit dem Äthan sind die möglichen Kohlenwasserstoffverbindungen, die man mit zwei Kohlenstoffatomen aufbauen kann, noch nicht erschöpft. Wir können ja auch annehmen, daß die beiden Kohlenstoffatome sich je zwei Hände reichen, jedes Atom also nur noch zwei Hände frei behält, so daß wir nur noch vier Wasserstoffatome anfügen können. So entsteht ein Körper C2H4, ebenfalls ein Gas, das unter dem Namen Äthylen bekannt ist, sowohl im Leuchtgas als auch im Rohpetroleum vorkommt und die nachstehende Strukturformel besitzt:
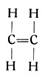
Bedient man sich der bereits erwähnten Atommodelle und benutzt dabei für den Kohlenstoff das reguläre Tetraeder, so hängen im Modell des Äthanmoleküls (Fig. 54) die beiden Kohlenstofftetraeder mit je einer Spitze zusammen und tragen an den sechs freien Ecken die sechs Wasserstoffmoleküle. Dagegen hängen sie beim Modell des Äthylenmoleküls (Fig. 55) mit je einer Kante zusammen und tragen an den vier freien Ecken vier Wasserstoffmoleküle. Es muß nun aber auch noch möglich sein, die beiden Kohlenstofftetraeder mit je einer Fläche aufeinander zu setzen, so daß sie sich nun mit je drei Valenzen binden und im ganzen nur noch zwei Ecken für zwei Wasserstoffatome frei bleiben. So entsteht ein Körper von der empirischen Formel C2H2 oder der Strukturformel
H – C ≡ C – H. Es ist ebenfalls ein Gas, und zwar das Azetylengas. (Fig. 56.)
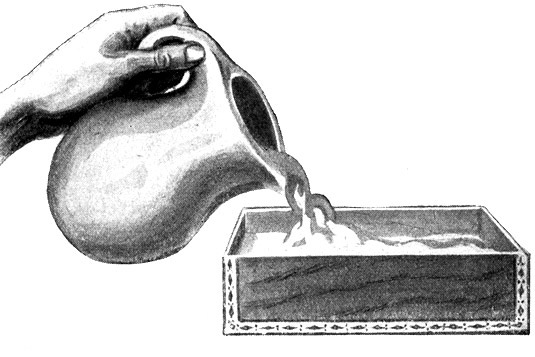
Fig. 44.
Die eine Hälfte wird mit Gipsbrei gefüllt.

Fig. 45.
In die Gipsfläche werden vor dem Erhärten vier Stäbchen an den Ecken der Riste eingesteckt. In der Mitte der Fläche wird die Glasperle genau bis zur Hälfte eingebettet.
Wir haben nun Grund zu der Annahme, daß ein Kohlenstoffatom einem anderen Kohlenstoffatom nur mangels angenehmerer Gesellschaft mehr als eine Hand gibt. Beim Äthan wurde tatsächlich nur eine Hand gegeben, alle anderen Hände konnten Wasserstoff greifen, und deshalb bezeichnet man diese Verbindung und überhaupt Kohlenwasserstoffverbindungen, bei denen dies der Fall ist, als gesättigte Kohlenwasserstoffverbindungen. Dagegen könnte das Äthylen, sobald seine beiden Kohlenstoffatome je eine Hand losließen, noch zwei weitere Wasserstoffatome binden. Es ist also eine ungesättigte Kohlenwasserstoffverbindung und sehr willig, noch Wasserstoff aufzunehmen. In noch stärkerem Maße muß dies natürlich beim Azetylen der Fall sein. Das zeigt sich in der Praxis durch die bedenkliche Neigung zu Explosionen.
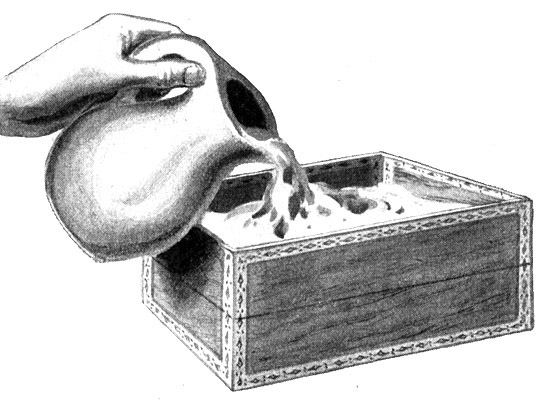
Fig. 46.
Nach dem Erhärten des Gipses in der ersten Formhälfte wird er mit Öl oder Petroleum getränkt, die zweite Formhälfte wird aufgesetzt und ebenfalls mit flüssigem Gipsbrei gefüllt.
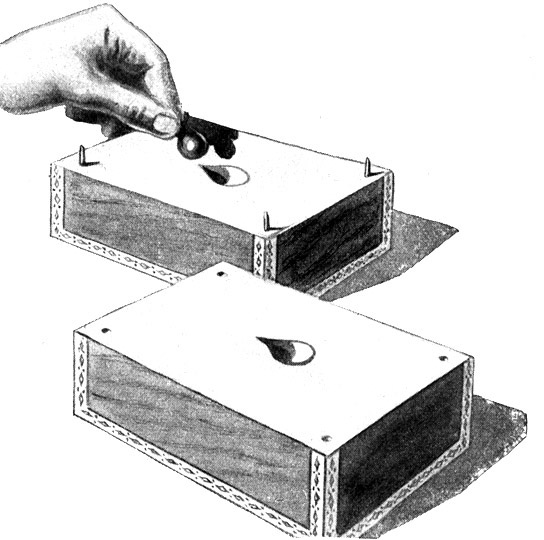
Fig. 47.
Nach dem Erhärten des Gipses werden die beiden Formhälften auseinandergenommen. Die Glasperle wird herausgenommen.
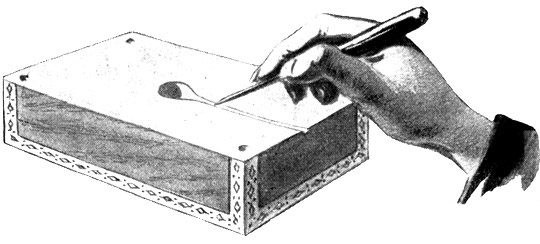
Fig. 48.
Mit einem spitzen Messer wird eine Eingußöffnung hergestellt. Beide Formhälften werden nochmals mit Öl getränkt und wieder zusammengesteckt
Komprimiert man Azetylen stark, so zerfällt es explosionsartig in Ruß und Äthan. Einzelne Kohlenstoffatome werfen dabei also den Wasserstoff ab und vereinigen sich zu Kohlenstoffmolekülen, während die frei werdenden Wasserstoffatome in die übrigbleibenden Azetylenmoleküle einwandern und mit ihnen Äthan ergeben.
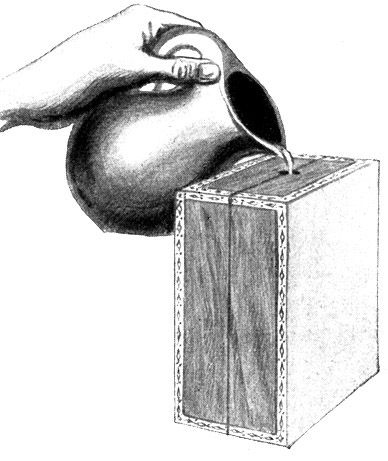
Fig. 49.
Die fertige Form wird mit Gips ausgegossen. Nach geraumer Zeit werden die Formhälften wieder aufgeklappt und eine fertige Gipsperle wird herausgenommen.

Fig. 50. Vorbereitung zur Herstellung räumlicher Molekülmodelle.
Gipsperlen sind gegossen. Aus Kartonpapier werden Tetraeder (gleichseitige Pyramiden) geklebt.
Mit den drei Gasen Äthan, Äthylen und Azetylen sind die für zwei Kohlenstoffatome möglichen Kohlenwasserstoffe erschöpft. Wir wollen nun noch einmal vom Äthan ausgehen und eine weitere Bildung in derselben Weise versuchen, in der das Äthan aus dem Methan entstand. Wir nehmen also drei Kohlenstoffatome, von denen das mittelste den beiden anderen je eine Hand reicht.
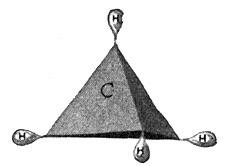
Fig. 51.
Methan = CH4.
Es behält demnach zwei freie Valenzen, die beiden anderen Atome aber je drei, so daß insgesamt acht Wasserstoffatome an die drei Kohlenstoffatome herantreten können. Es entsteht ein gasförmiger Körper von der Formel C3H8, welcher als Propan bezeichnet wird (Fig. 57) und ebenfalls im Rohpetroleum vorkommt. Seine Strukturformel lautet:
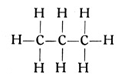
Wir können nun ein viertes Kohlenstoffatom anfügen oder, vielleicht anschaulicher gesagt, in die Reihe der vorhandenen Kohlenstoffatome einfügen. Dies Atom wird zwei Valenzen für die benachbarten Kohlenstoffatome brauchen und zwei Valenzen für Wasserstoffatome frei haben. So entsteht wieder ein Körper von der Formel C4H10, der als Butan bezeichnet wird. (Fig. 58.) Seine Strukturformel lautet:
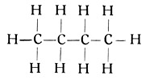
Wir können nun immer weiter Kohlenstoffatome einfügen, wobei jedes dieser Atome zwei freie Valenzen für zwei weitere Wasserstoffatome mitbringt. So entstehen der Reihe nach der Körper C5H12, das Penthan, der Körper C6H14, das Hexan der Körper C7H16, das Heptan usw. bis zu einem Körper C35H72.
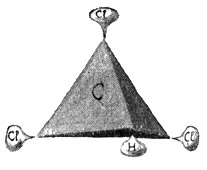
Fig. 52.
Chloroform = CHCl3.
Was wir hier vor uns haben, ist eine sogenannte homologe Kohlenwasserstoffreihe, deren Bildungsgesetz man beim Betrachten der Strukturformeln leicht erkennen wird. Wenn irgendeine Anzahl, beispielsweise m Kohlenstoffatome, wobei m irgendeine ganze Zahl bedeutet, die Mittelreihe in einer dieser Formeln bilden, so wird jedes dieser Atome zwei Wasserstoffatome binden, so daß 2 m Wasserstoffatome vorhanden sind.
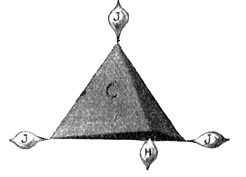
Fig. 53.
Jodoform = CHJ3.
Darüber hinaus binden aber die beiden Endglieder der Kohlenstoffreihe noch je 1 Wasserstoffatom, so daß noch 2 Wasserstoffatome hinzukommen, insgesamt 2m+2 Wasserstoffatome vorhanden sind. Die allgemeine Formel für die gesättigte Kohlenwasserstoffreihe heißt demnach CmH2m+2 . Die Körper dieser Reihe sind bis zu dem bereits genannten C35H72 im Rohpetroleum aufgefunden und analysiert worden. Die ersten Stoffe der Reihe sind Gase.

Fig. 54.
Äthan = C2H6.
Aber schon beim Pentan beginnen die flüchtigen Kohlenwasserstoffe. Pentan, Hexan und Heptan bilden die Hauptbestandteile des Automobilbenzins, welches ja durch Destillation aus dem Rohpetroleum gewonnen wird. Das Pentan verdunstet bereits bei 37 Grad Celsius, das Hexan bei etwa 69 und das Heptan bei 98. Mit den folgenden Gliedern der Reihe, dem Oktan, Nonan, Dekan usw., kommen wir zu den Bestandteilen des Lampenpetroleums, mit den noch höheren Gliedern zu den Bestandteilen der Schmieröle. Wie die Verdampfungstemperaturen, so steigen auch die Schmelztemperaturen der Glieder dabei immer mehr an. Schon beim Eikosan von der Zusammensetzung C20H42 liegt der Schmelzpunkt bei 37 Grad Celsius; wir haben ein Schmierfett, welches bei gewöhnlicher Temperatur fest ist.
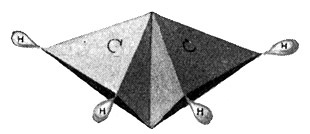
Fig. 55.
Äthylen = C2H4.
Die Öligkeit, Fettigkeit und Schmierfähigkeit dieser Kohlenwasserstoffe erklärt man sich direkt aus der Struktur ihrer Moleküle. Man nimmt an, daß diese langen Atomreihen oder Atomschlangen der einzelnen Moleküle leicht aufeinander gleiten können. Bringt man solch Schmierfett etwa zwischen zwei Metallflächen, so bilden diese fadenförmigen Moleküle auf jeder der beiden Flächen eine dünne, daran haftende Schicht, deren Moleküle sich in die Richtung der Bewegung legen und nun das leichte Gleiten ermöglichen. Wegen dieser Fettigkeit bezeichnet man diese reihenförmigen Kohlenwasserstoffe auch als aliphatische Kohlenwasserstoffe vom griechischen aleiphos, das Fett.

Fig. 56.
Azetylen = C2H2.
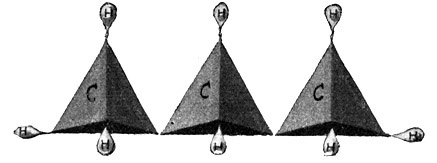
Fig. 57.
Propan = C3H8.
Zu einer ganz ähnlichen homologen Reihe gelangen wir nun auch, wenn wir vom ungesättigten Kohlenwasserstoff, dem Äthylen, ausgehen. Wir haben 2 Kohlenstoffatome, die sich mit je 2 Valenzen binden. Dem einen geben wir 2 Wasserstoffatome, dem anderen nur 1. Wir behalten also hier noch eine Valenz frei, an die wir noch ein Kohlenstoffatom hängen, dem wir nun noch 3 Wasserstoffatome anfügen können. So kommen wir zu einem Körper von der Zusammensetzung C3H6, dem Propylen (Fig. 59), ebenfalls einem Kohlenwasserstoffgas. Seine Strukturformel wird, wie folgt, angenommen:
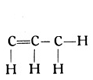
Der nächste Schritt in dieser Reihe bringt uns zu 4 Kohlenstoffatomen, von denen zwei doppelt gebunden sind, während die übrigen einfache Bindungen haben. So ergeben sich acht freie Valenzen und ein Stoff von der empirischen Formel C4H8.
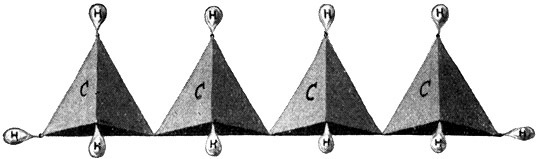
Fig. 58.
Butan = C4H10.
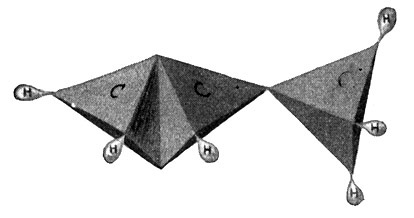
Fig. 59.
Propylen = C3H6.
Für die Struktur sind hier aber verschiedene Annahmen möglich, je nachdem man die doppelte Bindung zweier Kohlenstoffatome an das Ende der Reihe oder in die Mitte derselben verlegt. Es ergeben sich also zwei Strukturformeln:
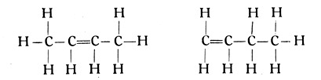
Man bezeichnet diese Verbindung mit 4 Kohlenstoffatomen als Butyen und unterscheidet ein α-Butylen (Fig. 60) und ein β-Butylen (Fig. 61). Es sei betont, daß diese beiden ungesättigten Kohlenwasserstoffe von gleicher quantitativer Zusammensetzung aber verschiedener Struktur nicht nur in der Theorie existieren, sondern auch in Wirklichkeit gefunden worden sind. Derartige Körper bezeichnet der Chemiker als isomere Stoffe vom griechischen isos, gleich und meros, teil. Die Isomeren sind also Stoffe, in denen die gleiche Anzahl Atome in verschiedener Weise im Molekül gelagert sind. Wir werden solchen Körpern noch häufig begegnen.
Nach den bisherigen Betrachtungen können wir nun auch die allgemeine Formel der Äthylenreihe ableiten. Im Gegensatz zur Methanreihe sind hier zwei Kohlenstoffatome doppelt gebunden. Für den Wasserstoff stehen deshalb zwei Valenzen weniger zur Verfügung, die Zahl der Wasserstoffatome muß um zwei geringer sein als in der Formel der Methanreihe. Haben wir also m Kohlenstoffatome, so haben wir nicht mehr 2m+2 sondern nur noch 2m Wasserstoffatome. Die allgemeine Formel der Äthylenreihe lautet demnach CmH2m.
Ebenso wie die Glieder der Methanreihe sind auch diejenigen der Äthylenreihe fettige Körper und kommen im Rohpetroleum vor. Von dem Amylen C5H10 an sind es flüssige, vom Eikolysen an feste Fette. Die Methanreihe wird wegen des zu ihr gehörenden Paraffins wohl auch als Paraffinreihe bezeichnet, die Äthylenreihe dagegen als Olefinreihe.
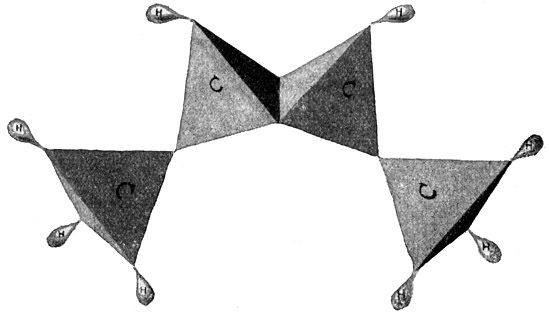
Fig. 60.
α-Butylen = C4H8.
Auch vom Azetylen kann man eine homologe Reihe bilden, deren einzelne Glieder teils im Teer und im Rohpetroleum gefunden, teils aus diesen Stoffen hergestellt wurden. Die Glieder der Azetylenreihe folgen der allgemeinen Formel CmH2m-2. Sie besitzen also noch zwei Wasserstoffatome weniger als die entsprechenden Glieder der Olefinreihe, sind noch ungesättigter als diese. Auf das Azetylen C2H2 folgt hier das Glied C3H4. Wie die beiden Strukturformeln zeigen, gibt es hier bereits beim zweiten Gliede der Reihe zwei verschiedene Gruppierungsmöglichkeiten der Atome und dementsprechend zwei Isomere, die als Allylen und als Allen bekannt sind.
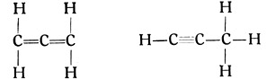
Noch größer werden die Variationsmöglichkeiten beim nächsten Gliede C4H6. Auch die Glieder dieser Reihe sind fettige Stoffe, die ersten Glieder gasförmig, die höheren flüssig. Theoretisch lassen sich noch weitere Reihen homologer Kohlenwasserstoffe mit den allgemeinen Formeln CmH2m-4 und CmH2m-6 usw. aufstellen. Auch Glieder dieser Reihen sind beispielsweise im Holzteer gefunden worden.
Während die gesättigten Kohlenwasserstoffe geringere Neigung zu chemischen Reaktionen besitzen, benutzen die ungesättigten begierig jede Gelegenheit, ihre doppelten und dreifachen Kohlenstoffbindungen aufzumachen und an die dadurch frei werdenden Valenzen irgend etwas anderes anzuhängen. Bei den gesättigten Kohlenwasserstoffen kann der Chemiker nur substituieren, er muß erst ein Wasserstoffatom austreiben, bevor er dafür irgend etwas anderes einsetzen kann. Bei den ungesättigten Wasserstoffen braucht er dagegen nur anzufügen oder, wie es in der Fachsprache genannt wird, zu addieren. Behandelt man beispielsweise ungesättigte Kohlenwasserstoffe mit Salzsäure von der Form HCl, so lagern sich die Chloratome der Salzsäure sehr leicht an die ungesättigten Valenzen dieser Stoffe an. Nun ist die Zahl der Kohlenwasserstoffe, die wir in den hier angeführten aliphatischen Reihen besitzen, schon an sich nicht gering. Sie beträgt unter Berücksichtigung der zahlreichen Isomeren mehrere hundert. Aber diese Zahl springt sofort in die Tausende, sobald wir nun anfangen, einzelne Wasserstoffatome durch die einwertigen Halogene Chlor, Brom und Jod zu ersetzen.
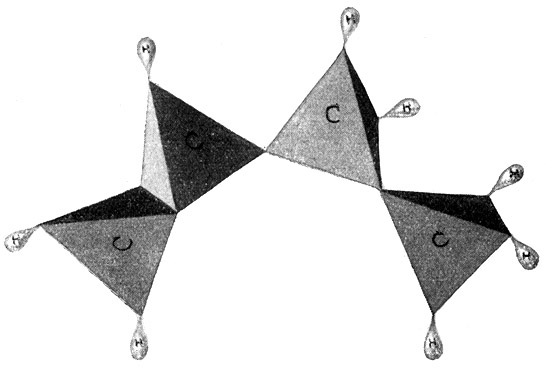
Fig. 61.
β-Butylen = C4H8.
Die Chemie, welche die griechische Sprache besonders in ihr Herz geschlossen hat, bezeichnet diese durch Substitution entstehenden Stoffe als Monoderivate, Biderivate, Triderivate usw., je nachdem ein, zwei, drei oder mehr Wasserstoffatome durch Atome des Chlors, Broms usw. ersetzt wurden. Schon bei dem einfachsten aller dieser Stoffe, dem Methan, ist die Zahl dieser Derivate sehr beträchtlich. Da finden wir unter den Monoderivaten das Methylchlorid CH3Cl, das Methylbromid CH3Br und das Methyljodid CH3J. Es folgen die Biderivate Methyldichlorid CH2Cl2, Methyldibromid CH2Br2 und Methyldijodid CH2J2 und die Triderivate Chloroform CHCl3, Bromoform CHBr3 und Jodoform CHJ3. Schließlich die Tetraderivate Tetrachlorkohlenstoff CCl4, Tetrabromkohlenstoff CBr4 und Tetrajodkohlenstoff CJ4. Aber mit diesen zwölf Derivaten ist die Reihe noch nicht geschlossen. Man kann ja auch bei einem Methanmolekül beispielsweise 1 Wasserstoffatom durch 1 Chloratom, ein anderes durch 1 Jodatom und ein drittes durch 1 Bromatom ersetzen. So entsteht eine weitere Reihe von Methanderivaten, deren Anzahl sich nur mit Hilfe der mathematischen Kombinationslehre berechnen läßt und sehr groß ist. Alle diese Stoffe, die man so nach der Theorie voraussagen kann, sind aber auch wirklich im Laboratorium dargestellt worden. Einige davon, wie das Chloroform und das Jodoform, haben eine große praktische Bedeutung gewonnen, andere bieten nur theoretisches Interesse.
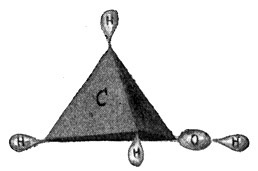
Fig. 62.
Methylalkohol = CH3OH.
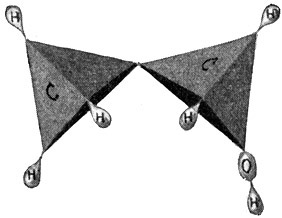
Fig. 63.
Äthylalkohol (Weingeist) = C2H5OH.
Wir wollen nun zu den Bausteinen unserer homologen Reihen, dem Kohlenstoffatom und dem Wasserstoffatom, noch das zweiwertige Sauerstoffatom hinzunehmen und kommen dadurch in die Lage, wiederum neue Reihen, die Alkoholreihen zu bilden. Das Sauerstoffatom ist zweiwertig, hat zwei Hände. Es kann sich daher an irgendeiner Stelle in einem der bisher behandelten Kohlenwasserstoffe zwischen 1 Kohlenstoffatom und 1 Wasserstoffatom schieben, indem es die durch eine solche Trennung frei werdenden beiden Valenzen mit seinen beiden Valenzen bindet. Schiebt sich 1 Sauerstoffatom ein, so entsteht ein einwertiger Alkohol, schieben sich mehrere Sauerstoffatome ein, so entstehen höherwertige Alkohole. Geschieht das bei gesättigten Kohlenwasserstoffen, so entstehen gesättigte Alkohole, im anderen Falle ungesättigte Alkohole. Während der Laie bei dem Wort Alkohol an einen ganz bestimmten Stoff, den Weingeist oder Äthylalkohol denkt, bedeutet das Wort für den Chemiker einen Verbindungstypus, zu dem Hunderte verschiedener Stoffe gehören.
Wir wollen zunächst mit der Paraffinreihe und einem Sauerstoffatom arbeiten, also gesättigte einwertige Alkohole bilden. Wir beginnen mit dem Methan, schieben 1 Sauerstoffatom ein und erhalten einen Körper von der empirischen Formel COH4 oder der Strukturformel
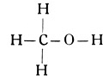
Der so gewonnene Stoff ist der berüchtigte Methylalkohol (Fig. 62), der aus den Destillationsprodukten des Holzes gewonnen und deshalb auch als Holzgeist bezeichnet wird. Sein Genuß ruft Vergiftungserscheinungen, speziell Erblindungen hervor, und seine Benutzung zur Verfälschung geistiger Getränke wird mit Recht als schweres Verbrechen bestraft.
Den nächsten Alkohol dieser Reihe bilden wir aus dem Äthan C2H6 (Fig. 63). Er hat die empirische Formel C2OH6 oder die Strukturformel
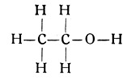
Dieser Stoff ist der bekannte Weingeist oder Äthylalkohol. Er bildet den wirksamen Bestandteil aller unserer geistigen Getränke und wird durch die Vergärung zuckerhaltiger Substanzen der sogenannten Maischen gewonnen. Der Äthylalkohol ist ein typisches Beispiel dafür, wie grundlegend sich der Charakter eines Stoffes durch eine verhältnismäßig geringfügige Veränderung seiner molekularen Zusammensetzung ändern kann. Hier entsteht aus dem Äthan, einem ziemlich giftigen Kohlenwasserstoffgas, durch die Einwanderung eines Sauerstoffatoms der reine Weingeist. Die nun folgenden einwertigen Alkohole der Paraffinreihe bieten weniger praktisches Interesse. Sie tragen ihre Bezeichnung nach dem Kohlenwasserstoff, aus dem man sie entstanden denken kann. Dabei wächst die Möglichkeit der Isomerie hier noch stärker als bei den einfachen Kohlenwasserstoffen. Wir finden in der Alkoholreihe nach dem Äthylalkohol die Propylalkohole, die Butylalkohole, die Amylalkohole usw. Ihnen allen ist es gemeinsam, daß sie an einer Stelle anstatt des einfachen Wasserstoffatoms die Verbindung OH enthalten, die ebenfalls einwertig ist, eine freie Valenz besitzt, da das Sauerstoffatom ja nur eine seiner Hände an das Wasserstoffatom gebunden hat.
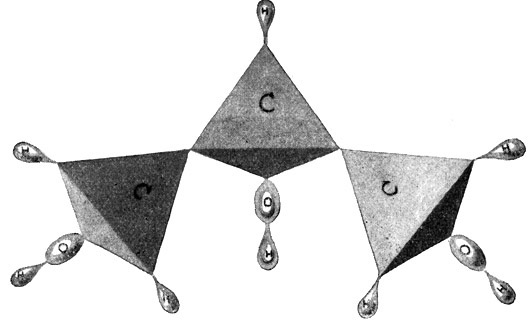
Fig. 64.
Glyzerin = C3H62OH.
(Der dreiwertige Propylalkohol.)
Solche Atomgruppen, die besonders fest zusammenzukleben scheinen und in ihrer Gesamtheit wie das Atom eines Elements wirken, bezeichnet man als Radikale. Die Atomgruppe OH bildet das einwertige Hydroxylradikal. Nach dieser Vorbemerkung dürfen wir die allgemeine Formel für die einwertigen gesättigten Alkohole in der folgenden Form niederschreiben: CmH2m+1OH. Für die zweiwertigen gesättigten Alkohole würde sich die allgemeine Konstitutionsformel CmH2m2OH ergeben. (Fig. 64). In entsprechender Weise lassen sich die Formeln für die Alkoholreihen der ungesättigten Kohlenwasserstoffe niederschreiben.
Als Beispiel für die dreiwertigen Alkohole mag ein Stoff genannt werden, den die Leser sicherlich nicht unter den Alkoholen vermutet haben werden. Es ist das Glyzerin (Fig. 64) mit der empirischen Formel C3H8O3, also der dreiwertige Alkohol des Propans C3H8.
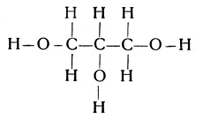
Bei der Bildung der Alkohole schob sich der Sauerstoff zwischen die in der Kohlenwasserstoffverbindung vorhandenen Atome ein. Es kann nun aber auch eine Entwicklung in der Richtung erfolgen, daß 1 Sauerstoffatom 2 Wasserstoffatome aus der Verbindung herausdrängt und sich an die beiden dadurch frei werdenden Valenzen anhängt. Die allgemeine Konstitutionsformel der gesättigten Kohlenwasserstoffe lautete CmH2m+2. Wenn ein Körper dieser Reihe nun 2 Wasserstoffatome abwirft und mit den dadurch frei werdenden beiden Valenzen ein zweiwertiges Sauerstoffatom bindet, so entsteht ein Stoff von der allgemeinen Formel CmH2mO.

Fig.65.
Formaldehyd = CH2O.
Diesen Stoff könnte man sich aber auch noch in anderer Weise entstanden denken, wenn man von dem zweiwertigen Alkohol der gesättigten Kohlenwasserstoffreihe ausgeht. Dieser besitzt ja die allgemeine Formel CmH2m2OH. Wenn man aus dieser Formel eine Gruppe H2O, d. h. das Molekül des Wassers, herausnimmt, bleibt ebenfalls ein Rest von der Form CmH2mO. Man kann diesen Stoff daher als einen Alkohol betrachten, dem Wasser entzogen ist, auf lateinisch als einen Alcoholum dehydratum. Von dieser Anschauungsweise her bezeichnet man derartige Verbindungen als Aldehyde. Es gibt natürlich zu jedem Kohlenwasserstoff auch das entsprechende Aldehyd, so daß die Zahl der Kohlenstoffverbindungen durch die große Reihe der Aldehyde wiederum eine gewaltige Vermehrung erfährt. Als Beispiel dieser Substanzen mag das Formaldehyd oder Methylaldehyd (Fig. 65) genannt sein, welches man sich aus dem Methan durch Abwurf zweier Wasserstoffatome und Einwanderung eines Sauerstoffatoms entstanden denken kann. Es ist ein bekanntes Desinfektionsmittel.
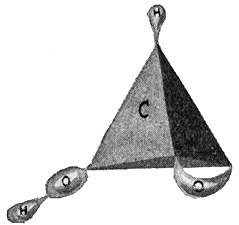
Fig. 66.
Ameisensäure = C · H · OH · O.
Die Einwanderung des Sauerstoffs kann nun noch weitergehen, zunächst in der Weise, daß 1 Sauerstoffatom 2 Wasserstoffatome verdrängt und ein anderes Sauerstoffatom sich zwischen ein Kohlenstoffatom und ein Wasserstoffatom einschiebt. Durch diese Veränderung entstehen aus den gesättigten Kohlenwasserstoffen Körper von der allgemeinen Formel CmH2mO2. Es sind die fetten Säuren. Weil sie von den gesättigten Kohlenwasserstoffen abgeleitet werden, heißen sie gesättigte Säuren. Auch hier entspricht wieder jedem Gliede der Kohlenwasserstoffreihe wenigstens ein Glied der Säurenreihe. Durch das Vorkommen isomerer Säuren erhöht sich die Zahl dieser Säuren aber noch beträchtlich. Zu dem Methan CH4 gehört in dieser Säurereihe die Ameisensäure CH2O2 (Fig. 66). Zum Äthan C2H6 die Essigsäure C2H4O2 (Fig. 67). In der Praxis gewinnt man die Essigsäure durch einen Oxydationsprozeß des Weingeistes C2H5OH, bei dem 2 Wasserstoffatome durch 1 Sauerstoffatom ersetzt werden. Dies Beispiel zeigt, daß man diese Säuren auch als einfache Oxydationsprodukte der entsprechenden einwertigen Alkohole auffassen kann. Von den höheren Gliedern dieser Reihe ist noch besonders die Stearinsäure C18H36O2 bekannt. Aus ihr bestehen unsere Stearinkerzen, die also eigentlich Stearinsäurekerzen heißen müßten.
Das hier begonnene Spiel, bei dem entweder 2 Wasserstoffatome durch 1 Sauerstoffatom ersetzt werden oder 1 Sauerstoffatom sich zwischen 1 Wasserstoff- und Kohlenstoffatom einschiebt, kann nun sowohl bei den Reihen der gesättigten als auch der ungesättigten Kohlenwasserstoffe nach Belieben wiederholt werden, und die Zahl der so entstehenden höheren Säuren ist unübersehbar groß.
Fig. 67.
Essigsäure = C2 · H3 · OH · O.
Nur einige wenige Beispiele mögen hier genannt werden. So ergibt die Verbindung C4H6O5 mit der Strukturformel
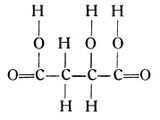
die Äpfelsäure, welche in unreifen Äpfeln, Weintrauben usw. vorkommt und diesen Früchten den sauren Geschmack verleiht. Die Verbindung C4H6O6 mit der Strukturformel
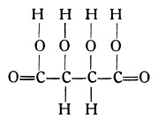
ist als Weinsäure bekannt und findet sich besonders im Safte der Weintrauben, aber auch noch in anderen Früchten. Die Verbindung C6H8O7 ist als Zitronensäure wohl bekannt. Sie findet sich in Zitronen, Orangen und Preiselbeeren, kommt aber gemischt mit anderen Säuren auch in Stachelbeeren und vielen anderen Früchten vor. Durch einfaches Erhitzen dieser Säure spaltet sich 1 Molekül Wasser ab. Der verbleibende Stoff von der Formel C6H6O6 ist die Akonitsäure, welche im Zuckerrohr, der Runkelrübe und anderen Pflanzen vorhanden ist. Die hier gegebenen Beispiele mögen für die Säuren genügen.
Schon jetzt ist die Zahl unserer Kohlenstoffverbindungen, die wir aus den einfachen Kohlenwasserstoffen unter Zuhilfenahme des Sauerstoffes ableiten konnten, gewaltig groß. Aber noch längst sind wir nicht am Ende. Betrachten wir noch einmal die Reihe der ungesättigten Wasserstoffe, nehmen wir beispielsweise das Äthan von der Strukturformel
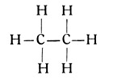
Wir können das eine Wasserstoffatom am Ende der Reihe abhaken und behalten dann ein einwertiges Radikal von der Strukturformel:
Zwei solcher Radikale können wir dann an die beiden Valenzen eines Sauerstoffatoms anhängen und erhalten so einen Körper von der folgenden Strukturformel:
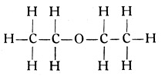
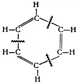
Körper dieser Art bezeichnet der Chemiker als Äther (Fig. 68). Selbstverständlich sind diese Stoffe nicht mit dem hypothetischen Lichtäther der Physiker zu verwechseln. Der vorstehend gegebene Äther wird nach den ihn bildenden Radikalen als Äthyläther bezeichnet. Man nennt ihn gelegentlich auch Schwefeläther, obwohl keine Spur von Schwefel in ihm vorhanden ist. Der Name mag mit der Herstellungsweise zusammenhängen, da man ihn sehr einfach durch Eingießen von Schwefelsäure in Weingeist mit nachherigem Abdestillieren des dabei entstehenden Äthers herstellt. Die allgemeine Konstitutionsformel der Äther lautet nach dem vorstehenden CmH2m+1OCmH2m+1. Zu jedem Kohlenwasserstoff gehört wenigstens 1 Äther.
Mit den Äthern nicht zu verwechseln sind die Ester. Wir konnten uns einen Äther in der Weise entstanden denken, daß ein Sauerstoffatom zwei einwertige Radikale eines Kohlenwasserstoffes bindet. In ähnlicher Weise entsteht ein Ester, wenn das Sauerstoffatom einmal ein einwertiges Radikal der Kohlenwasserstoffreihe und andererseits eine Säure bindet, welche eine Atomgruppe OH, ein Oxylradikal, abgestoßen hat und dadurch über eine freie Valenz verfügt. Durch ein solches Ausstoßen geht beispielsweise die Essigsäure C2H4O2 in ein einwertiges Radikal C2H3O über, und es bildet sich ein Stoff von der Strukturformel:
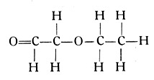
der nach seinen Komponenten als Essigsäureäthylester bezeichnet wird (Fig. 69). Die Zahl der möglichen Ester ist wesentlich größer als die Zahl der einfachen Kohlenwasserstoffe, da ja ein beliebiges Säureradikal und ein beliebiges Kohlenwasserstoffradikal unter Zunahme eines Sauerstoffatoms immer einen Ester bilden können. Infolge der unbeschränkten Kombinationsmöglichkeiten steigt hier die Zahl ins Ungemessene.
Die unabsehbar große Zahl der Verbindungen und Verbindungsgruppen, die wir bisher betrachteten, wurden ausnahmslos aus den aliphatischen Kohlenwasserstoffen abgeleitet, die dadurch gekennzeichnet sind, daß Kohlenstoffatome bei ihnen in einer Reihe liegen. Bedenken wir noch einmal, daß jedes Wasserstoffatom in diesen Verbindungen durch jedes andere einwertige Atom und jedes einwertige Radikal ersetzt werden kann, und daß sich an jeder Stelle, wo einfache Bindungen zwischen den Atomen herrschen, jedes beliebige zweiwertige Atom, wie zum Beispiel Sauerstoff und Schwefel oder aber auch jedes zweiwertige Radikal einschieben kann, so leuchtet es wohl ein, daß die Zahl aller dieser Verbindungen nicht mehr in die Tausende, sondern in die hunderttausende geht. Und doch haben wir damit erst die kleinere Hälfte der Kohlenstoffchemie durchwandert. Nach den reihenförmigen oder aliphatischen Kohlenwasserstoffen müssen wir nun noch die ringförmigen oder aromatischen Kohlenwasserstoffe betrachten.
Als man begann, den Steinkohlenteer zu destillieren und die einzelnen Destillationsprodukte genauer zu untersuchen, stieß man auf einen flüssigen klaren Stoff, der den Namen Benzol erhielt. Die einfache Analyse ergab sehr schnell, daß diesem Stoff die empirische Formel C6H6 zukäme. Es war also ein reiner Kohlenwasserstoff, dessen Molekül 6 Kohlenstoffatome und 6 Wasserstoffatome enthielt. Rein äußerlich zeigte er eine gewisse Ähnlichkeit mit den Kohlenwasserstoffen der aliphatischen Reihen. So wird ja auch heute noch Benzin und Benzol gleichberechtigt in unseren Kraftwagen verpufft. Gehörte das Benzol aber zu diesen reihenförmigen Kohlenwasserstoffen, dann mußte es ein stark ungesättigter Kohlenwasserstoff sein, konnte beispielsweise die Strukturformel besitzen.
Fig. 68.
Äthyläther = O · 2C2H5.
Aber die Reaktionen und das ganze Verhalten des Benzols beim Eingehen von Verbindungen sprachen durchaus gegen eine solche Struktur.
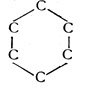
Länger als ein Menschenalter zerbrachen sich die Chemiker die Köpfe über die wahrscheinliche Struktur dieses Abkömmlings des Steinkohlenteers, bis dem Berliner Chemiker Kekulé die Erleuchtung kam. So bedeutend war diese Entdeckung, daß sich verschiedene Sagen darum ranken. Nach der einen Version soll Kekulé den sechsatomigen Benzolring im Traume gesehen haben (Fig. 70). Nach einer anderen Überlieferung soll ihm die Idee dazu während einer Fahrt auf den damals noch ganz neuen Berliner Omnibussen gekommen sein.
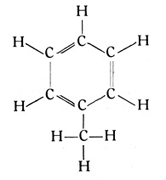
Mag dem sein, wie ihm wolle. Das Grundlegende, Neue bestand darin, daß man nun die Kohlenstoffatome im Benzolmolekül nicht mehr in einer Reihe, sondern in einem Kreise oder einem Sechseck angeordnet annahm, wobei zwischen zwei Atomen doppelte Bindung, zwischen den folgenden einfache, zwischen den dritten wieder doppelte Bindung usw. vorausgesetzt wurden. Jedes einzelne Kohlenstoffatom hängt dann mit drei Bindungen am sechsgliedrigen Ring und behält eine Valenz frei, an der im Falle des Benzols nur je 1 Wasserstoffatom liegt.
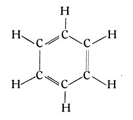
Der Leser, der den vorstehenden Ausführungen über die Kombinationsmöglichkeiten bei den reihenförmigen Kohlenwasserstoffen gefolgt ist, wird sofort einsehen, daß man natürlich auch an diese einwertigen Ecken des Benzolringes sehr viele einwertige Elemente oder Radikale substituieren kann, und daß schon dadurch die Zahl der Benzolabkömmlinge sehr bedeutend werden muß. Es besteht aber auch die zweite Möglichkeit, daß die doppelten Bindungen im Benzolringe in einfache übergehen, wodurch nun die Ecken des Ringes zweiwertig werden und die Zahl der möglichen Abkömmlinge noch einmal gewaltig steigt.
Zunächst eine kurze Bemerkung über die Entstehung des Benzols. Im Steinkohlenteer ist es fertig vorhanden. Aber der Steinkohlenteer wird bekanntlich bei der trockenen Destillation der Steinkohle in Rotglut gewonnen, und in der Steinkohle ist es noch nicht vorhanden. Betrachten wir nun unseren Benzolring mit seinen 6 Atomen Kohlenstoff und 6 Atomen Wasserstoff.
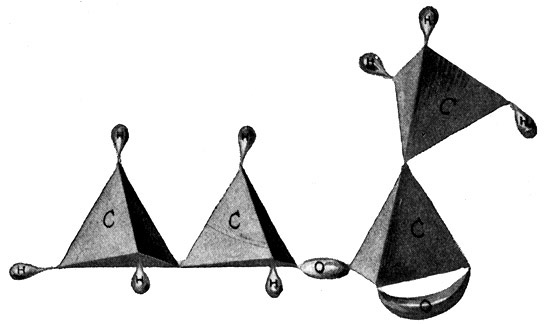
Fig. 69.
Essigsäureäthylester = C2H5 · O · C2H3O.
Nehmen wir an, daß durch irgendwelche äußeren Einflüsse die einfachen Bindungen dieses Ringes aufreißen, so daß drei Gruppen aus je 2 Kohlenstoff- und 2 Wasserstoffatomen entstehen. Die bei solcher Zerreißung frei werdenden Valenzen können sich natürlich nur zwischen den Kohlenstoffatomen der einzelnen Gruppen auswirken und dort zu einer dreifachen Bindung führen. Wir erhalten also bei dieser Sprengung aus einem Benzolmolekül drei Moleküle von der Form C2H2, d. h. drei Azetylenmoleküle. Umgekehrt kann man sich natürlich auch den Benzolring aus drei Azetylenmolekülen aufgebaut denken, und dieser Vorgang findet tatsächlich in der Natur statt, wenn man Azetylengas der Temperatur der beginnenden Rotglut aussetzt. Wir können also annehmen, daß das Azetylen, welches sich zweifellos aus der erhitzten Kohle entwickelt und zum Teil ja noch im Leuchtgas nachweisbar ist, sich zum anderen Teil in der rot glühenden Verkokungsretorte in Benzol verwandelt.

Fig. 70.
Kekulé erblickt intuitiv den Benzolring. Nicht
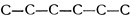
sondern
Einen solchen Vorgang, bei welchem mehrere gleichartige Moleküle ein neues größeres Molekül von der gleichen prozentualen Zusammensetzung bilden, bezeichnet der Chemiker als Polymerisation vom griechischen polys (viel) und meros (der Teil). Das Azetylen polymerisiert sich also in der Rotglut zu Benzol (Fig. 71).
Aus der Strukturformel des Benzolringes und noch deutlicher aus einem Modell, das wir uns aus Kohlenstofftetraedern zusammenbauen, geht klar hervor, daß der Benzolring vollkommen symmetrisch gebaut ist, daß seine sechs Ecken unter sich vollkommen gleichwertig sind. Solange wir daher nur eine dieser Ecken benutzen, um irgend etwas Einwertiges, ein Atom oder ein Radikal daran zu hängen, die übrigen fünf Ecken aber mit ihren fünf Wasserstoffatomen besetzt lassen, wird es vollkommen gleich bleiben, welche der sechs Ecken wir zum Anhängen benutzen. Benzolverbindungen, bei denen nur eine Ecke des Ringes in dieser Weise benutzt wird, bezeichnet man als Monoderivate vom griechischen monos (einzig, allein).
Die Benzolmonoderivate werden nach der vorstehenden Erläuterung keine Isomerie aufweisen können. Diese aus der Theorie zu machende Voraussage hat durch die Praxis ihre volle Bestätigung gefunden. Aber das Bild ändert sich, sobald wir zwei Ecken des Ringes zum Anhängen neuer Atome oder Atomgruppen benutzen. Numerieren wir die Ecken des Ringes von 1 bis 6 (siehe Fig. 72 bis 74), so ergeben sich für jedes Benzolbiderivat drei verschiedene Strukturmöglichkeiten.
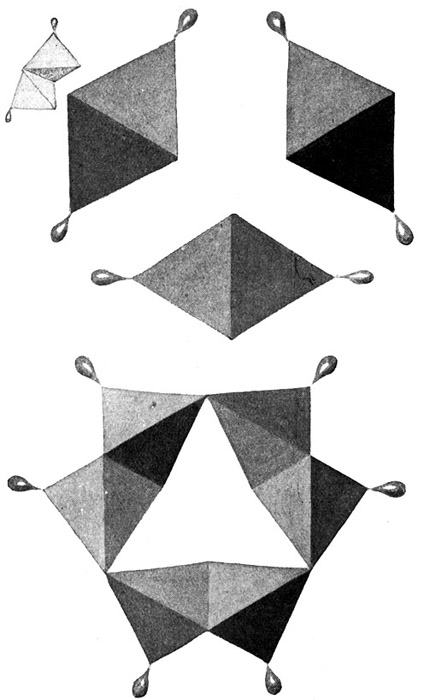
Fig. 71.
Zu Fig. 71. Die Polymerisation des Azetylens C2H2, in der Rotglut der Gasretorte zu Benzol: 3C2H2 = C6H6.
Drei Azetylenmoleküle C2H2 machen je eine Kohlenstoffbindung auf (links oben) und vereinigen sich. Azetylen 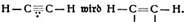
Aus 3 aufgespaltenen Azetylenmolekülen entsteht der Benzolring.
Wir können unsere beiden neuen Atome oder Atomgruppen entweder an zwei benachbarte Ecken hängen oder an zwei Ecken, die durch eine dazwischenliegende Ecke getrennt sind oder endlich an zwei Ecken, die durch drei dazwischenliegende Ecken getrennt sind. Daraus folgt theoretisch, daß es von jedem Benzolbiderivat drei isomere Formen geben muß, aber auch nicht mehr als drei Formen geben kann. Auch hier bestätigt die Praxis genau das von der Theorie Vorausgesagte. Man bezeichnet diese verschiedenen Biderivate entweder in der Weise, daß man die Nummern der besetzten Ringecken durch Komma getrennt vor die eigentliche Formel schreibt, zum Beispiel 1,2, was gleich 1,6 ist, oder 1,3, was gleich 1,5 ist, oder schließlich 1,4. Häufig benutzt man auch griechische Bezeichnungen. So heißen die 1,4-Verbindungen Paraverbindungen, die 1,3-Verbindungen Metaverbindungen und die 1,2-Verbindungen Orthoverbindungen. Auch bei den Triderivaten ergeben sich drei Möglichkeiten, je nachdem die drei Ecken 1,2 und 3 oder 1,3 und 4 oder 1,3 und 5 benutzt werden. Dabei ist immer angenommen, daß an die drei Ecken gleichartige Atomgruppen gehängt werden. Sind diese unter sich verschieden, so wird die Zahl der isomeren Formen einer Verbindung noch größer.
Aus dem Riesenheer der Benzolverbindungen mag an erster Stelle ein Stoff herausgegriffen werden, der sich neben dem Benzol im Steinkohlenteer findet und eigentlich noch viel mehr als das Benzol der Ausgangsstoff für die ganze Farbenchemie geworden ist, nämlich das Toluol. Das Toluol hat die empirische Formel C7H8. Es ist ein Monoderivat des Benzols, und zwar ein Methylbenzol (Fig. 75). An einer Ecke des Ringes findet sich an Stelle des einfachen Wasserstoffatoms das Methylradikal und so ergibt sich die folgende Strukturformel des Toluolmoleküles:
Wir können nun mit Methylradikalen weiter operieren, zwei Ecken damit besetzen und erhalten so drei isomere Dimethylbenzole. Diese Stoffe werden auch als Xylole bezeichnet, vom griechischen Xylos (das Holz), weil sie sich besonders im Holzteer finden. Schließlich können wir drei Ecken, vier, fünf und sechs Ecken des Benzolringes mit Methylradikalen besetzen und erhalten die entsprechenden Trimethylbenzole, Tetramethylbenzole, Pentamethylbenzole und Hexamethylbenzole. Alle diese Namen sind aus dem Griechischen unter Zuhilfenahme der griechischen Zahlwörter gebildet. Nimmt man noch die Typenbezeichnungen ortho, meta usw. hinzu, so entstehen Worte wie Orthodimethylbenzol. Diese Wortbildungen, die bei den komplizierteren Benzolverbindungen noch viel länger ausfallen, sind nicht sehr schön. Demosthenes und Thukydides hätten sie auch sicher nicht verstanden. Aber diese Bezeichnungen, die für die unzähligen, erst von der Chemie hergestellten neuen Stoffe erfunden werden mußten, geben in ihrer Zusammensetzung gleich die molekulare Struktur des betreffenden Stoffes an und sind deshalb unentbehrlich.
Betrachten wir noch einige der einfachsten Benzolderivate. Wir finden hier zunächst die Chlorbenzole, bei denen Wasserstoffatome durch Chloratome ersetzt sind. Ferner kann auch das einwertige Oxylradikal OH den Wasserstoff am Benzolring ersetzen. Geschieht dies einmal, so bekommen wir das Phenol mit der Strukturformel
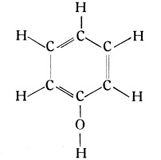
Fig. 72-74.
Die isomeren Biderivate des Benzols.
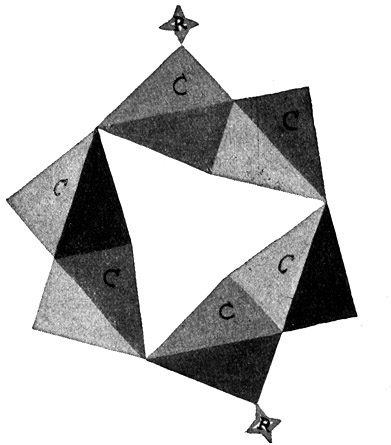
Fig. 72.
Die 1,4-Verbindung oder Paraverbindung.
Die beiden Substituenten hängen an den Ecken 1 und 4 des Benzolringes.
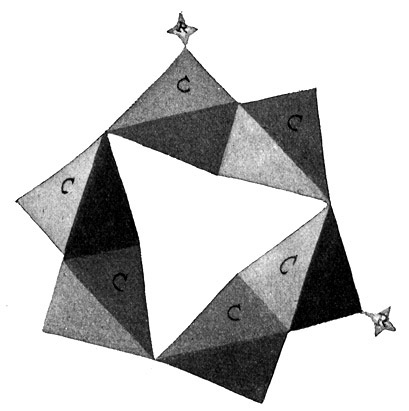
Fig. 73.
Die 1,3 (1,5) Verbindung oder Metaverbindung.
Die beiden Substituenten hängen an den Ecken 1 und 3 (oder 1 und 5) des Benzolringes.
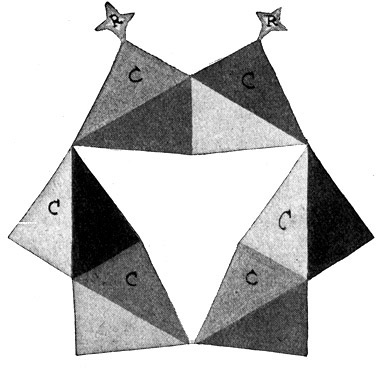
Fig. 74.
Die 1,2- (1,6) Verbindung oder Orthoverbindung.
Die beiden Substituenten hängen an den Ecken 1 und 2 (oder 1 und 6) des Benzolringes.
Es ist unter dem Namen Karbolsäure allgemein bekannt. Treten zwei Oxylradikale an den Benzolring, so gibt es Dioxylbenzole. Die dabei möglichen drei isomeren Formen dürften unseren Lesern, soweit sie Amateurphotographen sind, längst bekannt sein. Das Orthodioxylbenzol heißt auch Brenzkatechin, das Metadioxylbenzol wird Resorzin und das Paradioxylbenzol auch Hydrochinon genannt.
Treten drei Oxylradikale an den Benzolring, so bekommen wir die drei isomeren Formen des Trioxylbenzols, deren eine als Pyrogallol im photographischen Entwickler ebenfalls eine Rolle spielt.
Bei der Betrachtung der reihenförmigen Kohlenwasserstoffe lernten wir auch den Äthylalkohol oder Weingeist mit der Formel C2H5OH kennen. Wir können das Alkholmolekül, wie an der Formel gezeigt, zwischen den beiden Kohlenstoffatomen aufschneiden. Es zerfällt dann in das Methylradikal CH3 und in das Alkoholradikal CH2OH
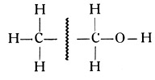
Auch das einwertige Alkoholradikal kann an Stelle des Wasserstoffatoms an den Benzolring treten, und so entstehen die mannigfachen Benzylalkohole. Für unsere weiteren Betrachtungen müssen wir nun das Stickstoffatom mit hinzuziehen. Der Stickstoff kann sowohl dreiwertig wie fünfwertig auftreten. Wir haben die Gründe dafür in dem Abschnitt vom System der Elemente kennengelernt. Fünfwertig bildet er mit zwei Sauerstoffatomen das einwertige Radikal NO2 von der folgenden Strukturformel:
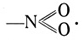
Tritt dies Radikal an den Benzolring heran, so entstehen die Nitrobenzole. Der Stickstoff bildet fernerhin dreiwertig mit dem Wasserstoff das einwertige Radikal NH2 von der Strukturformel:
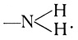
Tritt ein solches Amidoradikal an Stelle des Wasserstoffs an den Benzolring, so entsteht das Amidobenzol von der Strukturformel
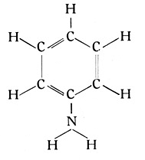
Es heißt auch Anilin (Fig. 76), und dieser Stoff hat einer ganzen Gruppe von farbenchemischen Erzeugnissen, den Anilinfarben, den Namen gegeben. Als der deutsche Chemiker Hofmann seine bahnbrechenden Arbeiten auf dem Gebiete der Farbenchemie begann, führte der Weg zuerst auch tatsächlich vom Toluol über das Anilin zu den Anilinfarben. Es waren ungemein leuchtende und prächtige, aber leider wenig lichtbeständige Farbstoffe. Heute ist dieser Weg längst verlassen, aber sehr unberechtigterweise sagt man den Teerfarbstoffen immer noch schlechte Lichtbeständigkeit nach.
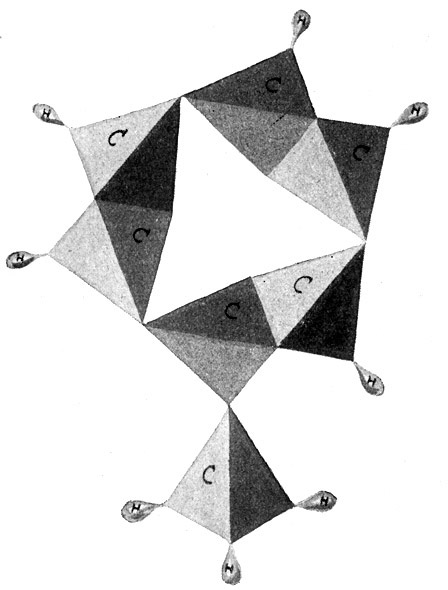
Fig. 75.
Das Toluol oder Methylbenzol = C6H5CH3.
Fig. 76.
Das Anilin oder Amidobenzol = C6H5 · NH2.
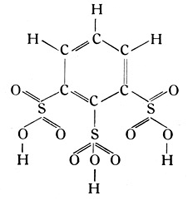
Die Schwefelsäure ist nach der Formel H2SO4 zusammengesetzt. Auch dies Molekül läßt sich in zwei einwertige Radikale zerspalten, nämlich in das Oxylradikal OH und in das Schwefelsäureradikal SO3H. Auch das Schwefelsäureradikal kann an Stelle des Wasserstoffatoms an den Benzolring treten und bildet je nach seiner Anzahl die verschiedenen Benzolsulfosäuren. Als Beispiel aus dieser Gruppe sei eine Benzoltrisulfosäure in ihrer Strukturformel gegeben:
Ganz allgemein läßt sich jede Verbindung an einer einfachen Bindungsstelle ihres Moleküls in zwei einwertige Radikale aufschneiden. So kann man auch das Azetaldehyd von der Formel CH3CHO in ein Methylradikal CH3 und ein Aldehydradikal CHO trennen, und das letztere kann den Wasserstoff des Benzolringes vertreten und dann die Gruppe der Benzaldehyde bilden. Der einfachste Körper dieser Gruppe hat die Strukturformel
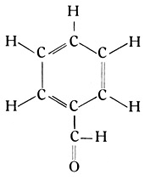
Er ist als Bittermandelöl seit langem wohlbekannt. Die Chemie ist heute imstande, das Bittermandelöl von der genauen Struktur des natürlichen Öls aus dem Benzol bzw. Toluol herzustellen.
Ein anderes einwertiges Radikal von der Form CO2H kann man sich durch Abspalten eines Wasserstoffatoms von der Ameisensäure CH2O2 entstanden denken. Tritt dies Radikal für ein Wasserstoffatom an den Benzolring, so entsteht die Benzoësäure (Fig. 78):
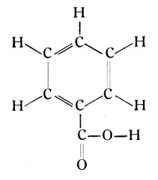
Diese Säure kommt als natürlicher Stoff im Benzoëharz und im Perubalsam vor und ist wohl als Parfümstoff allgemein bekannt. Als Benzolderivat wurde es von Hofmann erkannt und als Etappe auf dem Wege zum Anilinblau benutzt. Die höheren Verbindungen des Benzolrings mit den Radikalen der Ameisensäure haben ebenfalls Säurecharakter. Die Doppelverbindung ist als Phthalsäure bekannt, die dreifache Verbindung als Mellithsäure.
Aus den weiteren Benzolverbindungen mögen nur noch einige Stoffe herausgegriffen werden, die wegen der praktischen Verwendung allgemein bekannt sind. Zu diesen gehört die Salizylsäure, bei welcher ein Wasserstoffatom des Benzolrings durch ein Oxylradikal OH, ein benachbartes durch das Radikal der Ameisensäure CO2H ersetzt ist, so daß sich die folgende Strukturformel ergibt:
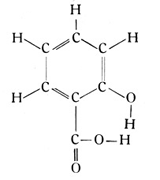
Fig. 77. Das Molekül des Bittermandelöls = C6H5 · CHO.
Die Salizylsäure trägt ihren Namen vom lateinischen Salix, was den Weidenbaum bedeutet. Die seit unvordenklichen Zeiten gebräuchliche Methode, Weidenrindentee als Heilmittel gegen rheumatische Erkrankungen zu benutzen, ist also nichts anderes als eine unbewußte Verwendung der Salizylsäure. Heute stellt man die Säure durch eine einfache Behandlung von Phenolnatrium oder Phenolkalium mit Kohlensäure her.
Fig. 78.
Das Molekül der Benzoësäure = C6H5 · C · O · HO.
Mit der Benzoësäure und der Salizylsäure sind wir nun bereits zu Verbindungen gelangt, welche die Chemie vor Kekulé und Hofmann nur als Erzeugnisse der Pflanzenwelt kannte, und deren Struktur man vor der Entdeckung des Benzolrings nicht zu deuten vermochte. Im folgenden mögen noch einige andere solcher aromatischen Pflanzensäuren angeführt werden. Beispielsweise die Mandelsäure von der Strukturformel
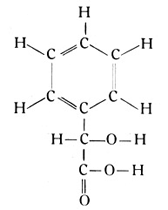
die in den Mandelfrüchten vorkommt. Zu diesen Säuren gehört weiter die Gallussäure von der Strukturformel
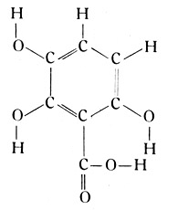
welche sich in den Galläpfeln, aber auch im Tee vorfindet. Weiter mag die Kumarsäure, welche im Steinklee vorkommt, genannt werden. Ihr Molekül baut sich um den Benzolring nach der folgenden Strukturformel auf:
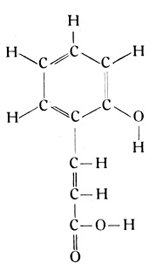
Nahe verwandt mit dieser Säure ist das Kumarin, welches dem Waldmeister Duft und Aroma verleiht.
Alle bisher behandelten aromatischen Kohlenwasserstoffe bauten sich um einen Benzolring auf. Die Zahl der auf diese Weise denkbaren und meistens auch hergestellten Verbindungen ist ungeheuer groß, viel größer als die Zahl der reihenförmigen Kohlenstoffverbindungen. Gibt es doch keinen reihenförmigen Kohlenwasserstoff oder Kohlenwasserstoffabkömmling, den man nicht in wenigstens zwei Radikale aufspalten könnte. Mit diesen Radikalen kann man dann aber in unendlicher Mannigfaltigkeit an den Ecken des Benzolringes operieren. Aber der Benzolring ist wiederum nur ein Teil aus der Chemie der ringförmigen Kohlenwasserstoffe.
Folgende weitere Möglichkeiten sind nicht nur theoretisch gegeben, sondern kommen auch wirklich vor:
Erstens können einzelne Kohlenstoffatome des Benzolringes durch andere Atome, beispielsweise durch Stickstoffatome, ersetzt werden. So entstehen aus den karbozyklischen Verbindungen, vom griechischen kyklos (der Kreis) und vom lateinischen carbo (der Kohlenstoff), die heterozyklischen Verbindungen, vom griechischen heteros (anders).
Fig. 79.
Das Molekül des Naphthalins = C10H8.
(Zwei Kohlenstoffringe verbunden. 2 x 6 - 2 = 10.)
Zweitens sind wir nicht auf den sechsgliedrigen Ring beschränkt. Es sind sowohl Ringe mit weniger, als mit mehr Gliedern möglich und kommen auch vor. Beispielsweise baut sich das Kautschukmolekül nur aus Kohlenstoff- und Wasserstoffatomen um einen achtgliedrigen Ring auf. Drittens endlich braucht ein Molekül nicht nur einen Ring zu enthalten, sondern es können mehrere Ringe in ihm verbunden sein, wobei nun wiederum zwei Möglichkeiten zu unterscheiden sind. Die Ringe können unmittelbar aneinanderliegen, also eine Seite und zwei Ecken gemein haben. Das ist beispielsweise bei dem Naphthalin, dem bekannten Mottenmittel, der Fall. Es enthält zwei Benzolringe, die nach der beistehenden Formel verbunden sind
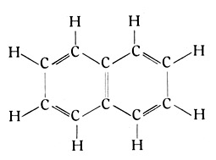
und an den acht freien Ecken acht Wasserstoffatome enthalten (Fig. 79). Theoretisch steht dem nichts im Wege, auch eine noch größere Anzahl von Benzolringen in dieser Weise zu verbinden, und es sind Stoffe bekannt, deren Molekül sich zweifellos in dieser Weise aufbaut. Die einzelnen Ringe können aber auch in einfacherer Weise in Verbindung stehen, indem irgendeine zweiwertige Atomgruppe an je einer Ecke der beiden Ringe angreift.
Als Beispiel einer solchen Verbindung mag das Molekül des Indigos genannt werden, welches nicht nur theoretisch, sondern auch praktisch besonderes Interesse bietet. Das Indigomolekül hat die beistehende Strukturformel:
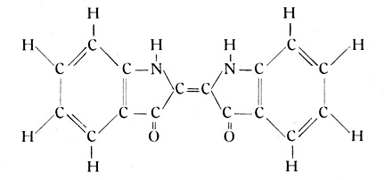
Es enthält zwei Benzolringe, bei denen je vier Ecken mit Wasserstoffatomen besetzt sind, während von den zwei freien Ecken je ein heterozyklischer Ring abzweigt. Dieser hat zwei Kohlenstoffatome mit dem Benzolring gemeinsam. An diese fügt sich einmal das zweiwertige Radikal NH, das andere Mal das gleichfalls zweiwertige CO. Als fünftes Glied schließt ein Kohlenstoffatom den Ring, welches dabei noch zwei Bindungen frei behält. An diese schließt sich die gesamte bisher besprochene Atomgruppe noch einmal an. Das ganze Molekül enthält also zwei sechsgliedrige karbozyklische und zwei fünfgliedrige heterozyklische Ringe.
Mit den Mitteln des chemischen Laboratoriums konnte man das Indigomolekül bereits seit geraumer Zeit aufbauen. Aber erst in den letzten Jahren des vorigen Jahrhunderts gelang es dem deutschen Chemiker A. von Baeyer, ein im großen brauchbares Herstellungsverfahren für den Indigofarbstoff zu finden, bei welchem der künstlich zusammengesetzte oder synthetische Indigo sich billiger stellte, als der aus der Indigopflanze gewonnene natürliche Farbstoff, von diesem Augenblick an ging die Indigokultur in Vorderindien unaufhaltsam zurück und ist heute fast vollkommen verschwunden. Viele tausende Hektar indischen Ackerbodens wurden dadurch wieder für den Anbau von Feldfrüchten frei. Die deutsche Erfindung trug auf diese Weise merklich zur Linderung der chronischen indischen Hungersnot bei, aber sie schürte auch den Unwillen der Engländer, der schließlich im Weltkriege zum Ausbruch kam.
Als ein anderes Beispiel dieser vielringigen Verbindungen sei noch das Rosanilin genannt. Es ist, theoretisch betrachtet, ein Methylalkohol, bei dem die drei Wasserstoffatome durch drei Benzolringe ersetzt sind, und hat die folgende Strukturformel
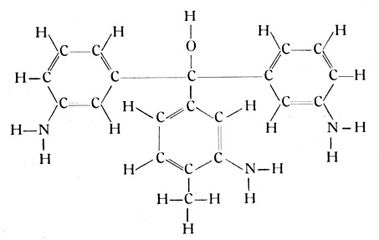
Wie der Name besagt, ist das Rosanilin ein roter Farbstoff. Ersetzt man aber die Wasserstoffatome seiner Benzolringe nach und nach durch Methylradikale, so entstehen neue Farbstoffe, die vom Rot hin immer mehr zum Violett umschlagen. Der bekannteste dieser Farbstoffe ist das Methylviolett der Kopierstifte und der Farbbänder für Schreibmaschinen. Andere Substitutionen führen zu grünen und blauen Farbstoffen, die man sich alle aus dem Rosanilin entstanden denken kann. Die Farbstoffchemie hat diese eigentümlichen Farbenwirkungen der verschiedenen Radikale genau studiert und vermag mit ziemlicher Sicherheit vorauszusagen, welche Farbstoffe bei dieser oder jener Umänderung einer Atomgruppe entstehen werden.

Fig. 80.
Der Steinkohlenwald der Primärzeit.
Vor hundert Millionen Jahren wurde er verschüttet. Als Steinkohle kam er wieder zutage. In der Retorte liefert er die Farben und Düfte vergangener Herrlichkeit.
Es erscheint fast wie ein Märchen, wenn man die wunderbar farbenprächtigen Stoffe betrachtet, welche die Chemie aus dem schwarzen, unansehnlichen Teertopf entstehen läßt. Die bunten Blüten einer längst vergangenen Urwelt (Fig. 80) scheinen hier unter den Beschwörungskünsten der modernen Chemie zu neuem Leben zu erwachen. In poetischer Weise hat Heinrich Seidel diesem Gedanken in den folgenden Versen Ausdruck gegeben:
»Und wieder her aus Teer und Schmeer
Zu neuem Glühn
In heller Macht, in Flammenpracht
Die Farben blühn,
Die einst im heiß durchfeuchteten,
Im wilden Urwald leuchteten:
Blau, Rot und Grün.«