
|
||||||||||||||
| Autoren | ∞ | Werke | ∞ | Neu | ∞ | Information | ∞ | Shop | ∞ | Lesetips | ∞ | Textquelle | ∞ | |
Anzeige. Gutenberg Edition 16. 2. vermehrte und verbesserte Auflage. Alle Werke aus dem Projekt Gutenberg-DE. Mit zusätzlichen E-Books. Eine einmalige Bibliothek. +++ Information und Bestellung in unserem Shop +++
Die moderne Chemie beruht auf der atomistischen Anschauung der Materie. Das Wesen dieser Anschauung wird sich am leichtesten an einem Beispiel erläutern lassen. Wenn man irgendeinen zusammengesetzten Stoff, etwa das bereits erwähnte Schwefeleisen, vornimmt und beginnt, ihn zu teilen, so wird man dabei mit fortschreitender Teilung zu immer kleineren Teilchen gelangen. Immer aber werden sich diese Teilchen als derselbe schwärzliche, ziemlich harte Stoff erweisen, den wir als Schwefeleisen kennen. In der Wirklichkeit werden wir bei unseren Teilversuchen an eine praktische Grenze kommen, wo uns eine weitere Teilung nicht mehr gelingt. Wir können beispielsweise das Schwefeleisen in einer Quarzschale mit einem Quarzstempel zu einem so feinen Pulver zerreiben, daß die Teilchen nicht mehr zwischen den Zähnen knirschen und nicht mehr auf der Lippe gefühlt werden. Aber immer noch wird ein Stäubchen dieses Pulvers unter dem Mikroskop als Schwefeleisen erkannt werden. Doch wenn auch unsere wirklichen Teilungsmittel versagen, so können wir den Versuch doch in Gedanken weiterführen. Im Geiste teilen wir solch ein winziges Pulverstäubchen weiter und immer weiter. Aber plötzlich kommen wir dabei an eine Grenze. Wir kommen an ein Schwefeleisenteilchen, welches allen unseren Versuchen, es mit mechanischen Mitteln weiter zu teilen, einen unüberwindlichen Widerstand entgegensetzt, so daß es physikalisch nicht weiter teilbar ist.
In diesem Teilchen haben wir nun die kleinste überhaupt existenzfähige Schwefeleisenmasse vor uns. Die kleine Masse heißt auf lateinisch molecula, und danach nennt man solch ein kleinstes Teilchen einer Verbindung ein Molekül. Den Teilungsprozeß, den wir bisher vollzogen haben, können wir etwa mit der Teilung eines Regiments Soldaten in kleine und immer kleinere Abteilungen bis hinab zum einzelnen Manne vergleichen. Durch einfache Befehlsgewalt wird der Oberst des Regiments imstande sein, kleine und kleinere Gruppen von Soldaten zu schaffen, bis schließlich der einzelne Soldat als der kleinste, durch Befehlsgewalt noch zu erreichende Teil des Regimentes vor ihm steht.
In ähnlicher Weise haben wir durch mechanische Teilung das kleinste Teilchen einer Verbindung, das Molekül, erreicht. In beiden Fällen sind wir dabei an eine Grenze gelangt. Der Oberst kann dem einzelnen Soldaten unter Androhung der schwersten Strafen befehlen, sich noch weiter zu zerteilen; er wird diese Teilung auch mit schärfster Befehlsgewalt nicht erreichen. Wenn aber etwa eine Granate den Soldaten trifft, daß seine Gliedmaßen nach allen Richtungen auseinanderfliegen, dann haben wir eine weitere Teilung. Aber die Teile sind jetzt etwas anderes, als das Ganze war. Es sind nicht mehr komplette Soldaten, sondern nur noch verschiedene Stücke, aus denen der Soldat zusammengesetzt war. Beim Molekül müssen wir ebenfalls zu schärferen Teilungsmitteln greifen. Mit chemischen Mitteln gelingt es uns, das Schwefeleisenmolekül nochmals in zwei Teile zu zerspalten. Aber nach dieser Teilung haben wir nicht mehr zwei Teilchen Schwefeleisen, sondern ein Teilchen Schwefel und ein Teilchen Eisen vor uns. Verschwunden ist der schwarze Stoff; gelber Schwefel und blankes Eisen sind wie durch Zauber an seine Stelle getreten.

Fig. 5.
Der Kommandeur läßt die Mannschaften der Kompagnie in Gruppen von je vier Mann auseinander treten. Sein Kommando genügt, um diese Teilung durchzuführen.
Die kleinsten Teilchen, die wir nun nach dieser neuen, gewaltsameren Teilung vor uns haben, sind die kleinsten Mengen, in denen die beiden Stoffe Schwefel und Eisen überhaupt existieren können, die kleinsten Teilchen der sogenannten chemischen Grundstoffe oder Elemente. Bei ihnen versagte noch bis vor kurzem jeder weitere Teilungsversuch, und man nannte sie deshalb auf griechisch Atome, d. h. die »Unzerschneidbaren«.

Fig. 6.
Der Unteroffizier läßt die Gruppe von vier Mann in zwei Rotten von je zwei Mann auseinander treten. Das ist eine Teilung der Materie mit physikalischen Mitteln (Kommandogewalt).
Die Atome wurden als die letzten Bausteine der Natur betrachtet. Jedes Atom stellte eine für jeden Grundstoff ein für allemal bestimmte Menge von Materie vor und war außerdem mit gewissen anziehenden und teilweise auch abstoßenden Kräften behaftet, durch welche die Bildung der mannigfachen zusammengesetzten Stoffe oder chemischen Verbindungen zuwege kam.

Fig. 7.
Der »Herr Unteroffizier« befiehlt dem einzelnen Mann, sich noch weiter zu teilen. Aber gegenüber dem einzelnen Mann (Molekül) versagt das physikalische Mittel der Kommandogewalt.
Diese atomistische Auffassung der Materie war an und für sich nicht neu. Schon die Philosophen der ältesten griechischen Zeit sprachen von Atomen und verstanden darunter ebenfalls die kleinsten, nicht weiter zerlegbaren Teilchen der Materie, aus denen die ganze Welt sich aufbauen sollte. Aber die moderne Wissenschaft ist ein gutes Stück weitergegangen. Sie hat die Abmessungen, die Gewichte und sonstigen Eigenschaften sowohl der Moleküle wie der Atome sehr genau ergründet. Daß diese Teilchen äußerst klein sein mußten, lag von vornherein auf der Hand. Wußte man doch, daß beispielsweise ein zehntausendstel Milligramm des Moschusparfüms von empfindlichen Nasen noch auf einen Meter Entfernung gerochen wird, also jedenfalls große Mengen von Duftteilchen, von Moschusmolekülen, nach allen Seiten hin ausstrahlen muß. Wußte man doch ferner aus der Optik und der Lehre von den Interferenzfarben, daß die Wandung einer Seifenblase eine Dicke von weniger als einem zehntausendstel Millimeter zu erreichen pflegt, bevor die Blase platzt.
Es konnte sich bei den Molekülen sowohl wie bei den Atomen also nur um Gebilde handeln, die auch unter dem stärksten Mikroskop niemals sichtbar zu werden vermochten, weil sie wesentlich kleiner waren als die kleinsten sichtbaren Lichtwellen. Daß es trotzdem in unserem Jahrhundert gelungen ist, die Abmessungen und Massen dieser kleinsten Teilchen genau zu ermitteln und in besonderen Versuchsanordnungen sogar einzelne frei fliegende Moleküle sichtbar zu machen, bleibt deshalb eine besonders glänzende Leistung des menschlichen Geistes.
Als nun die analytische Chemie daranging, die mannigfachen Stoffe, die ihr geboten wurden, zu zerlegen, kam sie bei diesen Zerlegungen wieder und immer wieder auf eine verhältnismäßig geringe Anzahl von Stoffen, die allen weiteren Zerlegungsversuchen widerstanden und ebendeshalb als chemische Grundstoffe oder Elemente angesprochen wurden. Die Zahl dieser Elemente hat im Laufe der letzten hundert Jahre ziemlich geschwankt, heute haben wir triftige, in späteren Abschnitten zu besprechende Gründe zu der Annahme, daß es im ganzen 92 solcher Grundstoffe oder Elemente gibt.

Fig. 8.
Erbittert über das Versagen der Kommandogewalt (des physikalischen Mittels) greift der Unteroffizier zu einem stärkeren (chemischen) Mittel. Er richtet eine Kanone auf den Soldaten und feuert sie ab.
Der Jetztzeit erscheint eine solche Zurückführung der tausendfach verschiedenen Stoffe auf noch nicht hundert Elemente als etwas ganz Selbstverständliches. Für die Chemiker vergangener Generationen bedeutete es aber immer wieder ein Wunder und erregte Staunen, wenn sich beispielsweise Zucker in schwarzen Kohlenstoff, Wasserstoffgas und Sauerstoffgas spalten ließ. Oder wenn Eiweiß in die fünf Grundstoffe Kohlenstoff, Wasserstoff, Sauerstoff, Stickstoff und Schwefel zerlegt wurde. Oder wenn sich im roten Blute des Menschen das Eisenmetall in solcher Menge nachweisen ließ, daß es zur Zeit der Französischen Revolution Mode wurde, das Eisen aus den Körpern verstorbener Angehöriger chemisch herauszuziehen und Gedenkmünzen von der Größe eines Fünfmarkstückes daraus prägen zu lassen. Oder wenn sich etwa das nützliche Kochsalz als eine Verbindung des silberblanken Natriummetalles und des grünen Chlorgases entpuppte. Oder wenn im grünen Farbstoff der Baumblätter ebensoviel Eisen nachgewiesen wurde wie im roten Blut. Doch über solch Staunen und Wundern vergaßen auch die Chemiker jener Zeit nicht die exakte Forschung.
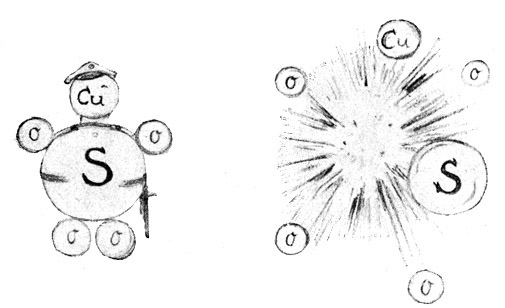
Fig. 9.
Der Soldat geht in Stücke, aber die einzelnen Stücke sind keine Soldaten mehr. (Das Molekül wurde in Atome zerlegt.) Die Zersplitterung der Moleküle in Atome, Kupfervitriol (CuSO4), zerfällt unter der Wirkung chemischer Mittel in Cu, S und 4 O.
Sie zerlegten nicht nur, sondern sie trieben quantitative Analyse und stießen bei der genauen Bestimmung der in den Verbindungen enthaltenen Gewichtsmengen der Elemente sehr bald auf das Gesetz der multiplen Proportionen. Bei der Zerlegung des Wassers fand man, daß auf ein Gewichtsteil Wasserstoff stets 8 Gewichtsteile Sauerstoff entfallen. Die Zerlegung der verschiedenen Oxydationsstufen des Stickstoffes zeigten, daß sich 14 Gewichtsteile Stickstoff entweder mit 8 Gewichtsteilen Sauerstoff oder mit 16 Teilen, mit 24, mit 32 oder mit 40 Teilen verbinden.
Ähnliche Gewichtsproportionen zeigten sich bei allen untersuchten Verbindungen. Man hätte nun annehmen können, daß jedes Atom eines jeden Elementes die gleiche Schwere oder Masse besäße, so daß also im Wasser vielleicht 1 Wasserstoffatom und 8 Sauerstoffatome zu 1 Wassermolekül verbunden seien. Aber die Annahme, daß alle Atome verschiedener Elemente gleiche Massen besäßen, war in keiner Weise besonders begründet. Eine andere Annahme führte sofort zu sehr viel einfacheren und übersichtlicheren Formeln für die zusammengesetzten Körper; die Annahme nämlich, daß zwar die Atome ein und desselben Elementes alle dasselbe Gewicht besäßen, daß aber die Atome verschiedener Elemente verschieden schwer seien.
Sobald man sich einmal zu dieser Annahme besonderer Atomgewichte entschloß, mußte es schon im Verlaufe der quantitativen Analysen möglichst vieler Verbindungen gelingen, wenigstens die Verhältnisse der Atomgewichte zueinander festzustellen. Wenn man beispielsweise das Atomgewicht des Wasserstoffes gleich 1 setzte, so mußte man sagen können: »1 Stickstoffatom ist 14mal schwerer als 1 Wasserstoffatom« usw. Dabei mußte man freilich vor Täuschungen auf der Hut sein. Nach den vorstehend gegebenen Proportionen für Wasser- und Stickstoffverbindungen könnte man sich beispielsweise versucht fühlen, das Atomgewicht des Sauerstoffes 8 mal so schwer als das des Wasserstoffes anzusetzen. Tatsächlich ist es aber 16 mal so groß. Denn im Wasser sind 2 Atome Wasserstoff mit 1 Atom Sauerstoff verbunden. In den angeführten Stickstoffverbindungen sind 2 Atome Stickstoff mit 1 Atom Sauerstoff, 1 Atom Stickstoff mit 1 Atom Sauerstoff, 2 Atome Stickstoff mit 3 Atomen Sauerstoff, 1 Atom Stickstoff mit 2 Atomen Sauerstoff und 2 Atome Stickstoff mit 5 Atomen Sauerstoff verbunden. Durch die Untersuchung sehr vieler verschiedener Verbindungen ließen sich solche Unsicherheiten in der Annahme der Atomgewichte fast ganz ausmerzen. Die vollständige Sicherheit boten freilich erst die gleichzeitigen Volumenmessungen bei gasförmigen Verbindungen.
So entstand durch die Arbeiten der analytischen Chemie eine Liste der chemischen Grundstoffe, und als wichtigstes Erkennungszeichen konnte jedem Element sein Atomgewicht in dem hier besprochenen Sinne beigegeben werden. Die Tabelle auf Seite 33 gibt diese Elemente, die formelmäßige Abkürzung jedes Elementes und sein Atomgewicht. Wenn man nun eine chemische Formel niederschreibt, beispielsweise diejenige des Wassers H2O, so besagt diese Formel erstens, daß 1 Molekül Wasser sich aus 2 Wasserstoffatomen und 1 Sauerstoffatom aufbaut. Sie besagt aber auch darüber hinaus, daß 16 Gewichtsteile Sauerstoffgas mit 2 Gewichtsteilen Wasserstoffgas zu 18 Gewichtsteilen Wasser verbunden sind. In diesen chemischen Formeln bedeutet das Symbol eines Elementes, also O für Sauerstoff oder H für Wasserstoff, auch zugleich eine dem Atomgewicht entsprechende Gewichtsmenge. Die kleinen Ziffern hinter den einzelnen Symbolen geben an, wie oft das betreffende Atomquantum in der Verbindung enthalten ist.
So lautet beispielsweise die Formel für die Schwefelsäure H2SO4. In 1 Molekül Schwefelsäure sind also 2 Atome Wasserstoff mit dem Gewicht je 1, also 2 Gewichtsteile Wasserstoff enthalten. Ferner 1 Atom Schwefel mit dem Atomgewicht 32 und 4 Atome Sauerstoff mit dem Atomgewicht je 16. Es folgt demnach aus der Formel, daß in 98 Gewichtsteilen Schwefelsäure 2 Gewichtsteile Wasserstoff, 32 Gewichtsteile Schwefel und 64 Gewichtsteile Sauerstoff vorhanden sind.
Die Arbeiten der analytischen Chemie lieferten nun zunächst Formeln der hier gegebenen Art, sogenannte empirische Formeln, vom griechischen empeiros, die Erfahrung, welche erfahrungsmäßig die Zahl und die Art der in einem Molekül der betreffenden Verbindung vorhandenen Atome angaben. Zunächst mochte es dabei scheinen, als ob man ganz beliebige Atome zu irgendeiner Verbindung zusammensetzen könne. Sehr bald aber entdeckte man eine andere Gesetzmäßigkeit, die in ihren weiteren Auswirkungen mindestens ebenso bedeutungsvoll werden sollte wie das Gesetz der multiplen Proportionen und die daraus abgeleiteten Atomgewichte. Es war dies die Entdeckung der verschiedenen Wertigkeiten oder Valenzen der Elemente.

Fig. 10
Das einwertige Wasserstoffatom H hat eine freie Valenz, eine freie Hand, für die es Betätigung sucht.
Man stellt sich die chemischen Valenzen bildlich am besten derart vor, daß man annimmt, jedes Atom wäre mit einer gewissen Anzahl von Händen begabt, mit denen es andere Hände fassen könne. Wenn wir in der Atomtabelle (siehe S. 52 u. 33) den Kohlenstoff als vierwertig verzeichnet finden, so bedeutet das also, daß er gewissermaßen vier Hände besitzt, während der zweiwertige Sauerstoff nur über zwei Hände, der einwertige Wasserstoff nur über eine Hand verfügt. Unter Berücksichtigung dieser Annahme können wir uns dann leicht vorstellen, wie beispielsweise ein vierhändiges Kohlenstoffatom vier einhändige Wasserstoffatome ergreift und mit ihnen eine Verbindung eingeht. Diese Verbindung ist das Methangas, welches bei den Schlagwetterexplosionen eine üble Rolle spielt. Die empirische Formel dieses Gases würde man CH4 schreiben. Sie besagt, daß in 16 Gewichtsteilen Methan 12 Gewichtsteile Kohlenstoff und 4 Gewichtsteile Wasserstoff vorhanden sind, da das Atomgewicht des Kohlenstoffes gleich 12 ist. Wir können nun auf Grund der Wertigkeiten aber auch noch eine andere Formel, die Strukturformel des Methans, geben, indem wir die Valenzen, jene Hände, mit denen die Atome eines Moleküls sich halten, durch Striche andeuten, mit denen wir die einzelnen Symbole verbinden. So kommen wir zu der folgenden Strukturformel des Methans:
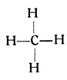
Sie zeigt uns mancherlei. Insbesondere ersehen wir daraus sogleich, daß zwischen einem Kohlenstoffatom und dem Wasserstoff überhaupt nur diese Methanverbindung möglich ist. Wollten wir weniger Wasserstoffatome an das Kohlenstoffatom heranhängen, so würden Kohlenstoffvalenzen frei bleiben. Freie Valenzen aber, die sozusagen unbefriedigt in die Luft ragen, darf es nach der Valenztheorie nicht geben. Zu unserem Kohlenstoffatom gehören also mindestens 4 Wasserstoffatome. Andererseits dürfen es aber auch nicht mehr sein, denn über seine 4 Valenzen hinaus besitzt ja der Kohlenstoff nichts, mit dem er fremde Valenzen packen könnte.

Fig. 11.
Mit einem anderen Wasserstoffatom H verbindet es sich deshalb zu einem Wasserstoffmolekül von der Form H2
Die Valenztheorie ist namentlich auf dem Gebiete der Kohlenstoffverbindungen, der organischen Chemie außerordentlich fruchtbar gewesen. Es mag bei dieser Gelegenheit erwähnt sein, daß die Scheidung der Chemie in eine organische und anorganische heute längst überholt und grundlos geworden ist. Sie stammt aus einer Zeit, in der man die Stoffe, welche den Körper lebendiger Organismen bildeten, noch für etwas ganz Besonderes hielt. Heute bezeichnen wir das große Gebiet der organischen Chemie besser als Kohlenstoffchemie, da es in einem lebendigen Organismus kaum eine Verbindung gibt, die keinen Kohlenstoff enthält.
(Gerundet. Anstelle des Originals Tabelle aus dem Jahr 1995 eingefügt. Re)
| Element | Symbol | Ordnungszahl | Atomgewicht |
| Aluminium | Al | 13 | 26,982 |
| Antimon (Stibium) | Sb | 51 | 121,76 |
| Argon | Ar | 18 | 39,948 |
| Arsen | As | 33 | 79,922 |
| Barium | Ba | 56 | 137,33 |
| Beryllium | Be | 4 | 9,0122 |
| Bismut (Wismut) | Bi | 83 | 208,98 |
| Blei (Plumbum) | Pb | 82 | 207,2 |
| Bor | B | 5 | 10,811 |
| Brom | Br | 35 | 79,904 |
| Cadmium | Cd | 48 | 112,41 |
| Caesium | Cs | 55 | 132,91 |
| Calcium | Ca | 20 | 40,078 |
| Cer | Ce | 58 | 140,12 |
| Chlor | Cl | 17 | 35,453 |
| Chrom | Cr | 24 | 51,996 |
| Cobalt (Kobalt) | Co | 27 | 58,933 |
| Dysprosium | Dy | 66 | 162,50 |
| Eisen (Ferrum) | Fe | 26 | 55,845 |
| Erbium | Er | 68 | 167,26 |
| Europium | Eu | 63 | 151,97 |
| Fluor | F | 9 | 18,998 |
| Gadolinium | Gd | 64 | 157,25 |
| Gallium | Ga | 31 | 69,723 |
| Germanium | Ge | 32 | 72,61 |
| Gold (Aurum) | Au | 79 | 196,97 |
| Hafnium | Hf | 72 | 178,49 |
| Helium | He | 2 | 4,0026 |
| Holmium | Ho | 67 | 164,93 |
| Indium | In | 49 | 114,82 |
| Iod (Jod) | I | 53 | 126,90 |
| Iridium | Ir | 77 | 192,22 |
| Kalium | K | 19 | 39,098 |
| Kohlenstoff (Carboneum) | C | 6 | 12,011 |
| Krypton | Kr | 36 | 83,80 |
| Kupfer (Cuprum) | Cu | 29 | 63,546 |
| Lanthan | La | 57 | 138,91 |
| Lithium | Li | 3 | 6,941 |
| Lutetium | Lu | 71 | 174,97 |
| Magnesium | Mg | 12 | 24,305 |
| Mangan | Mn | 25 | 54,938 |
| Molybdän | Mo | 42 | 95,94 |
| Natrium | Na | 11 | 22,990 |
| Neodym | Nd | 60 | 144,24 |
| Neon | Ne | 10 | 20,180 |
| Nickel | Ni | 28 | 58,693 |
| Niob (Niobium) | Nb | 41 | 92,906 |
| Osmium | Os | 76 | 190,23 |
| Palladium | Pd | 46 | 106,42 |
| Phosphor | P | 15 | 30,974 |
| Platin | Pt | 78 | 195,08 |
| Praseodym | Pr | 59 | 140,91 |
| Protactinium | Pa | 91 | 231,04 |
| Quecksilber (Mercurium, Hydrargyrum) |
Hg | 80 | 200,29 |
| Rhenium | Re | 75 | 186,21 |
| Rhodium | Rh | 45 | 102,91 |
| Rubidium | Rb | 37 | 85,468 |
| Ruthenium | Ru | 44 | 101,07 |
| Samarium | Sm | 62 | 150,36 |
| Sauerstoff | O | 8 | 15,999 |
| Scandium | Sc | 21 | 44,956 |
| Schwefel (Sulfur) | S | 16 | 32,066 |
| Selen | Se | 34 | 78,96 |
| Silber (Argentum) | Ag | 47 | 107,87 |
| Silicium | Si | 14 | 28,086 |
| Stickstoff (Nitrogenium) | N | 7 | 14,007 |
| Strontium | Sr | 38 | 87,62 |
| Tantal | Ta | 73 | 180,95 |
| Tellur | Te | 52 | 127,60 |
| Terbium | Tb | 65 | 158,93 |
| Thallium | Tl | 81 | 204,38 |
| Thorium | Th | 90 | 232,04 |
| Thulium | Tm | 69 | 168,93 |
| Titan | Ti | 22 | 47,867 |
| Uran | U | 92 | 238,03 |
| Vanadium | V | 23 | 50,942 |
| Wasserstoff | H | 1 | 1,0079 |
| Wolfram | W | 74 | 183,84 |
| Xenon | Xe | 54 | 131,29 |
| Ytterbium | Yb | 70 | 173,04 |
| Yttrium | Y | 39 | 88,906 |
| Zink | Zn | 30 | 65,39 |
| Zinn (Stannum) | Sn | 50 | 118,71 |
| Zirconium | Zr | 40 | 91,224 |
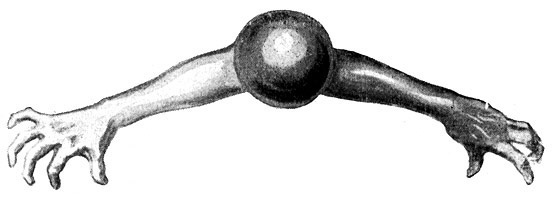
Fig. 12.
Das zweiwertige Sauerstoffatom hat gewissermaßen zwei freie Hände (Valenzen), für die es Betätigung sucht.
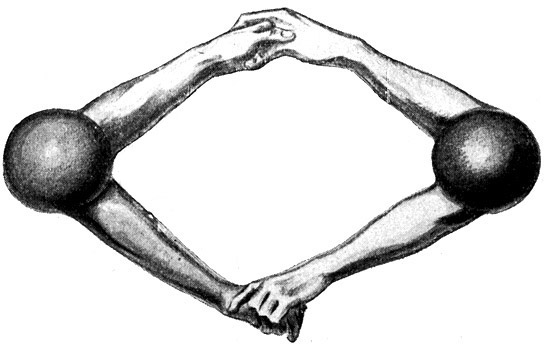
Fig. 13.
Deshalb packt es ein anderes, ebenfalls zweiwertiges Sauerstoffatom bei dessen beiden Valenzen (Händen) und bildet mit ihm ein Sauerstoffmolekül von der Form O2.
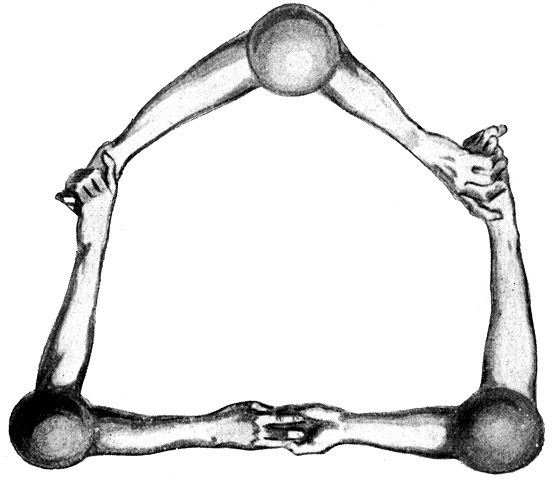
Fig. 14.
Es besteht aber auch die Möglichkeit, daß drei der zweihändigen Sauerstoffatome sich zu einem Ozonmolekül von der Form O3 zusammenfinden. Aber das dritte wird hier sehr bald als überflüssig empfunden und aus dem Ring hinausgestoßen.
Aber unsere Strukturformel, so schön und lehrreich sie sonst auch sein mag, steht auf dem Papier. Sie liegt in einer Ebene, während wir uns unter Molekülen und Atomen doch räumliche Gebilde vorstellen, die keinerlei Ursache haben, sich nur in zwei Dimensionen zu entwickeln. Diesem Übelstand hat man schon frühzeitig durch besondere Atommodelle abzuhelfen versucht, obwohl man von der wirklichen Gestalt der Atome noch wenig wußte. So suchte man als Modell für das vierwertige Kohlenstoffatom einen geometrischen Körper, der vier gleichberechtigte und symmetrisch zueinander liegende Ecken im Räume besaß, und fand ihn in dem regulären Tetraeder, der dreiseitigen Pyramide.
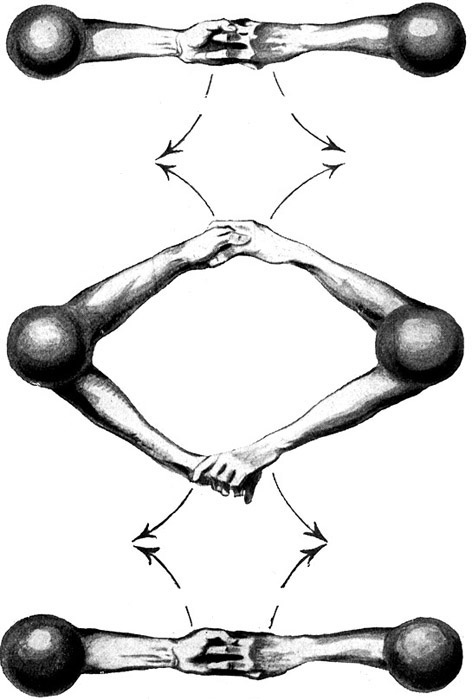
Fig.15.
Knallgas ist ein physikalisches Gemenge von Sauerstoffmolekülen (O2) und der doppelten Anzahl Wasserstoffmoleküle (H2).
Oben: Wasserstoffmolekül H2
Mitte: Sauerstoffmolekül O2
Unten: Wasserstoffmolekül H2
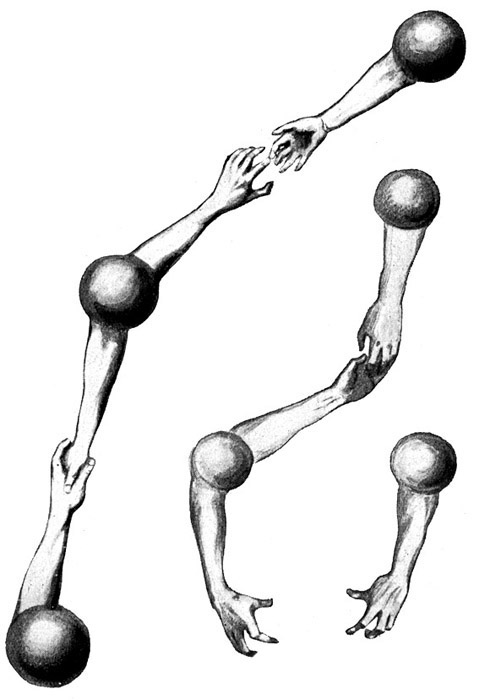
Fig. 16.
Durch einen elektrischen Funken wird die Explosion eingeleitet. Das Sauerstoffmolekül O2 spaltet sich in zwei Sauerstoffatome O, und ebenso die Wasserstoffmoleküle H2 in je zwei Wasserstoffatome H. Es erfolgt eine neue Gruppierung der Atome und Bindung der Valenzen nach der Gleichung O2 + 2H2 = 2OH2
Aus dem Knallgas entsteht Wasserdampf OH2
Nimmt man nun für die einwertigen Wasserstoffatome noch perlenartige Körper als Modelle, die ihrer einen Valenz entsprechend in eine Spitze auslaufen, so kann man sich das Modell des Methanmoleküls etwa in der Weise als räumliches Gebilde darstellen, wie es die Abbildung (Fig. 51) zeigt. Selbstverständlich sind derartige Modelle zunächst nur Hilfsmittel für die menschliche Vorstellungskraft. Wir haben nach den neuesten Erkenntnissen der Atomforschung, auf die in einem späteren Abschnitt näher eingegangen werden wird, sogar bestimmten Grund zu der Annahme, daß die Kohlenstoffatome ganz anders aussehen als reguläre Tetraeder. Trotzdem aber haben sich solche Molekülmodelle, bei denen die verschiedene Wertigkeit der sie zusammensetzenden Atome durch passend gewählte geometrische Körper zum Ausdruck kommt, äußerst nützlich erwiesen. Es ist dadurch möglich geworden, nicht nur die Struktur bereits bekannter Stoffe zu erklären, sondern auch alle außerdem noch möglichen Verbindungen vorauszusagen und einen beträchtlichen Teil dieser bisher unbekannten Körper auch wirklich herzustellen.
Wir haben gesehen, daß das kleinste physikalische Individuum, das Molekül, aus den kleinsten chemischen Individuen, den Atomen, zusammengesetzt ist, und daß diese Zusammensetzung durch die Wirkung der Atomvalenzen erfolgt. Das gilt nicht nur für die Moleküle der Verbindungen, sondern auch für die Moleküle der Elemente selbst. Ein einwertiges Wasserstoffatom kann auf die Dauer nicht selbständig existieren. Seine eine freie Hand wird immer eine andere freie Hand suchen. Das Wasserstoffmolekül müssen wir uns daher als zweiatomig vorstellen, d. h. zwei einwertige Wasserstoffatome haben sich hier zu einem Molekül verbunden. Durch diese Verbindung sind nun aber ihre Hände vollkommen in Anspruch genommen, das Wasserstoffmolekül ist in seinen Valenzen gesättigt, es hat, so lange nicht besondere äußere Einwirkungen auftreten, keine Ursache, sich zu verändern und irgendwie chemisch aggressiv zu werden.
Der Sauerstoff ist zweiwertig. Das einzelne Sauerstoffatom hat also gewissermaßen zwei Hände, mit denen es zwei andere Hände fassen kann. Wir können uns deshalb auch das Sauerstoffmolekül zweiatomig vorstellen. Wie etwa zwei Menschen sich die Hände reichen, so reichen sich hier die beiden Sauerstoffatome ihre Valenzen und bilden das Sauerstoffmolekül. Während wir aber das Wasserstoffmolekül überhaupt nur zweiatomig denken können, ergeben sich beim Sauerstoff noch andere Möglichkeiten. Es können ja auch drei Menschen in der Weise zusammentreten, daß jeder seinen Nachbarn je eine Hand reicht. So entsteht ein kleiner Kreis von drei Personen.
Nach den Erfahrungen aus dem Tanzsaal kann man aber sagen, daß eine Gruppe von zwei Personen fester zusammenhält als eine von drei Personen. Genau die gleichen Verhältnisse finden sich beim Sauerstoffmolekül. Neben dem zweiatomigen Molekül des gewöhnlichen Sauerstoffes gibt es das dreiatomige Molekül des sogenannten aktiven Sauerstoffes, des Ozons. Mit Hilfe der elektrischen Glimmlichtentladungen gelingt es, einen beträchtlichen Teil des gewöhnlichen Luftsauerstoffes in aktiven Sauerstoff zu verwandeln, die Luft zu ozonisieren. Aber das Ozon ist eine sehr wenig stabile Sauerstofform. Sehr schnell wird ein Atom aus dem Molekül ausgestoßen, so daß ein gewöhnliches zweiatomiges Molekül übrigbleibt. Das ausgestoßene Molekül mit seinen beiden freien Valenzen sucht aber schnellstens und dringendst neue Betätigung und Bindung. Oft geschieht dies sehr einfach, indem zwei aus zwei Ozonmolekülen hinausgeworfene Sauerstoffatome sich zu einem neuen Sauerstoffmolekül vereinigen; es entstehen also aus zwei Ozonmolekülen drei Sauerstoffmoleküle.
Nun ist aber etwas Besonderes zu bemerken. Ein solches Atom, welches durch irgendwelche Umstände aus irgendeiner Molekülverbindung hinausgeworfen wird, ist besonders unternehmungslustig. Die chemische Forschung hat dies eigenartige Verhalten schon früh entdeckt. Sie bezeichnet diesen Zustand, bei welchem einzelne Atome eines Stoffes plötzlich frei werden, als den Status nascendi, als den Zustand des Geborenwerdens. In diesem Zustande ist der betreffende Stoff zunächst in Form einzelner Atome mit freien Valenzen vorhanden und sucht natürlich für diese mit Gewalt neue Bindungen. So ist der Sauerstoff, der beim Zerfall des Ozons frei wird, ein äußerst energisches Oxydationsmittel. Er stürzt sich mit Wucht auf alle Verbindungen seiner Umgebung, die etwa noch Sauerstoff aufnehmen, also oxydieren können und bildet mit ihnen neue Verbindungen. So wird beispielsweise ein Gummischlauch, durch den man die ozonisierte Luft eines Glimmlichtapparates leitet, in wenigen Minuten vollkommen morsch und brüchig. Trinkwasser, durch welches man Ozon in Bläschenform hindurchgehen läßt, wird von sämtlichen etwa darin befindlichen Bakterien radikal befreit, da das Ozon die winzigen Körperchen dieser kleinsten Lebewesen momentan oxydiert, tötet, verbrennt.
Man könnte nun die Frage aufwerfen, ob nicht noch andere Formen des Sauerstoffmoleküls aus noch mehr Atomen möglich sind. Denkbar sind solche Formen natürlich. Ebenso, wie man beliebig viele Menschen in einen Kreis stellen und sich die Hände reichen lassen kann, könnte man sich auch noch Sauerstoffmoleküle aus vier, fünf und aus noch mehr Atomen vorstellen. Aber wir sahen ja schon, daß das dreiatomige Ozonmolekül eine sehr labile, d. h. kipplige Verbindung war, und die Existenz noch höheratomiger Sauerstoffmoleküle ist daher wenig wahrscheinlich. Sollten sich solche Moleküle auch unter dem Einflusse der elektrischen Glimmlichtentladungen gelegentlich bilden, so würden sie wahrscheinlich noch schneller zerfallen als das dreiatomige Ozon.
Nach diesen Betrachtungen läßt sich auch die Frage nach dem Molekülbau der übrigen Elemente schnell beantworten. Im allgemeinen wird man immer zweiatomige Moleküle annehmen dürfen; denn ein Atom mit x Valenzen wird stets die x Valenzen eines zweiten gleichartigen Atomes binden können. Ausnahmen machen die Elemente, welche in den sogenannten allotropen Modifikationen vorkommen, wie Kohlenstoff, Phosphor und Schwefel. Hier muß man für die verschiedenen Modifikationen verschiedenatomige Moleküle annehmen, da nur so die verschiedenen Erscheinungsformen ein und desselben Elementes erklärt werden können. Beispielsweise wird angenommen, daß im Molekül des Diamanten, d. h. des kristallisierten Kohlenstoffes, wenigstens vier Kohlenstoffatome vorhanden sind. Eine andere Ausnahme bilden schließlich die erst in neuester Zeit entdeckten Edelgase Neon, Krypton, Xenon und Argon. Sie sind chemisch absolut träge, zu gar keiner Reaktion oder Verbindung zu veranlassen. Man nimmt daher an, daß sie gar keine Valenz besitzen, und daß bei ihnen das Molekül einatomig ist, daß also Molekül und Atom in diesen Fällen identisch sind.
Wir sahen, daß jedes Element in statu nascendi, also beim Auftreten freier Atome, besonders bindungslustig ist. Wie haben wir uns nun die Entstehung chemischer Verbindungen vorzustellen? Nehmen wir zunächst den einfachen Fall, daß Sauerstoff und Wasserstoff sich zu Wasserdampf verbinden. Diese Verbindung erfolgt nicht so ohne weiteres. Wir können ja bekanntlich Sauerstoff und Wasserstoff mischen, ohne daß zunächst irgendwelche Reaktion eintritt. Wir haben in diesem Gemisch das bekannte Knallgas. Es genügt indes ein elektrischer Funke oder eine Erhitzung, um die Verbindung in äußerst stürmischer Weise vonstatten gehen zu lassen. Das Ergebnis dieser Verbindung sind Wasserdampfmoleküle von der Form H2O. Es muß sich also ein zweiatomiges Sauerstoffmolekül in zwei Sauerstoffatome spalten, und jedes dieser Atome muß in ein zweiatomiges Wasserstoffmolekül eindringen, es aufbrechen und sich mit den beiden dadurch in statum nascendi geratenen Wasserstoffatomen vereinigen.
Diese Vereinigung findet nun, sobald sie in einem Knallgasgemenge an einer Stelle erst einmal eingesetzt hat, äußerst schnell und stürmisch durch das ganze Gemenge hindurch statt. Dabei aber tritt noch etwas anderes auf. Es wird Wärme frei. 1 Kilogramm Wasserstoff, welches in dieser Weise in reinem Sauerstoff zu Wasserdampf verbrennt, liefert eine Wärmemenge von 30 000 Kalorien, eine Wärmemenge, die genügt, um 1 Kubikmeter Wasser um 30 Grad Celsius zu erwärmen. Da nach dem mechanischen Wärmeäquivalent 1 Kalorie gleich 425 Meterkilogramm ist, entspricht diese Wärmemenge einer mechanischen Energie von 12,7 Millionen Meterkilogramm. Man müßte das Gewicht eines Eisenbahnwagens 1000 Meter tief abstürzen lassen, um die gleiche Energie zu gewinnen.
Wo stammt diese Energie her? Sie muß zweifellos vor der Verbindung der Wasserstoff- und Sauerstoffatome bereits irgendwie vorhanden gewesen sein und nun bei der Entstehung der Verbindung frei werden. Wir haben berechtigten Grund zu der Annahme, daß es sich hier um eine potentielle Energie, um eine Energie der Lage handelt. Ein Eisenbahnwagen im Gewichte von 12,7 Tonnen, der sich 1000 Meter über dem Meeresspiegel befindet, besitzt ja auch eine solche Energie der Lage. Geben wir ihm Gelegenheit, 1000 Meter abzustürzen, so wird diese Energie frei und kommt letzten Endes auch als Wärme zum Vorschein. Wir wissen aber beim Eisenbahnwagen, daß es nicht seine Lage allein macht, sondern seine Lage im Schwerefeld der Erde. Auf dem Monde beispielsweise würde er bei einem Sturz von 1000 Metern nur einen Bruchteil der hier genannten Energie entwickeln und an einer entfernten Stelle im Weltraum noch viel weniger. Die potentielle Energie setzt also immer das Vorhandensein bestimmter Kraftfelder voraus, und wir müssen annehmen, daß etwa um die Sauerstoffatome herum räumlich sehr kleine, aber äußerst starke Kraftfelder existieren, welche die Wasserstoffatome mit solcher Gewalt heranstürzen lassen, daß die riesigen Energiemengen frei werden.
Wenn unser Eisenbahnwagen einmal abgestürzt ist, so hat er seine Energie hergegeben. Wir müssen ihn mit demselben Aufwand an Energie erst wieder auf seine alte Höhe emporheben, wenn wir den alten Zustand wieder haben wollen. In gleicher Weise müssen wir die gewaltige Energie von 30 000 Kalorien aufwenden, wenn wir den Wasserdampf wieder in seine Bestandteile Sauerstoff und Wasserstoff zerlegen wollen. Man erreicht dies am bequemsten durch die elektrische Zersetzung und ist dabei in der Lage, die aufgewandte Energie sehr genau festzustellen. Es leuchtet auch ein, daß der Wasserdampf bzw. das Wasser sehr stabile Verbindungen sein müssen, da es ja so großer Energien bedarf, um sie zu zerlegen.
Die Erfahrung hat gezeigt, daß bei der Entstehung der allermeisten chemischen Verbindungen entweder Wärme frei oder gebunden wird. Nach dem Vorschlage des dänischen Physikers Thomsen bezeichnet man diese Erscheinung als Wärmetönung. Die Wärmetönung kann entweder positiv oder negativ sein. Im vorliegenden Falle des Wasserdampfes haben wir eine positive Wärmetönung, denn hier wird bei der Entstehung der Verbindung Wärme gewonnen. Man bezeichnet eine solche Verbindung auch als eine exothermische Verbindung. Die exothermische Verbindung enthält weniger Energie als die Stoffe, welche sie bildeten. Wasser oder Wasserdampf ist also eine exothermische Verbindung, weil sie weniger Energie als ihre beiden Komponenten Wasserstoff und Sauerstoff enthält.
Es gibt nun aber auch Verbindungen mit negativer Wärmetönung, sogenannte endothermische Verbindungen. Diese besitzen mehr Energie als die Stoffe, aus denen sie zusammengesetzt wurden. Hier muß also bei dem Zerfall der Verbindung in ihre Komponenten Wärme frei werden. Solche Verbindungen sind beispielsweise alle Explosivstoffe. Auch hier genügt ein Fünkchen, aber es bewirkt nicht wie beim Knallgas die Entstehung einer Verbindung aus ihren Komponenten, sondern den Zerfall der bestehenden Verbindung in ihre Komponenten, beispielsweise den Zerfall der Schießbaumwolle in Wasserdampf, Kohlensäure und Stickstoff.
Die bei molekularen Umgruppierungen und neuen Molekülbildungen auftretenden Energien sind sehr gewaltig. Sie sind viel größer als die bei einfachen mechanischen Vorgängen vorkommenden Energien und werden von der Technik der Gegenwart in weitgehendstem Maße ausgenutzt. Beruht doch unsere ganze Energiegewinnung durch Dampfmaschinen und Verbrennungsmotoren auf der Ausnutzung der bei der Entstehung exothermer Verbindungen, d. h. bei Verbrennungsvorgängen, frei werdenden Energien, während umgekehrt unsere ganze Kriegstechnik in Gewehren und Geschützen die Energien endothermer Verbindungen, die bei deren Zerfall frei werden, benutzt. Unser ganzes Lebensbild ist fast ausschließlich durch solche chemischen Umgruppierungen bedingt.