
|
||||||||||||||
| Autoren | ∞ | Werke | ∞ | Neu | ∞ | Information | ∞ | Shop | ∞ | Lesetips | ∞ | Textquelle | ∞ | |
Anzeige. Gutenberg Edition 16. 2. vermehrte und verbesserte Auflage. Alle Werke aus dem Projekt Gutenberg-DE. Mit zusätzlichen E-Books. Eine einmalige Bibliothek. +++ Information und Bestellung in unserem Shop +++
Der Stickstoff bildet den größten Teil unserer Atmosphäre. Besteht die Luft doch zu vier Fünftel aus diesem Gase und zu einem Fünftel aus Sauerstoffgas. Die Rechnung ergibt, daß in der Atmosphäre rund vier Trillionen Kilogramm Stickstoff vorhanden sind. Über einen Mangel an diesem für unser Leben so wichtiger Element werden wir uns also so leicht nicht zu beklagen haben.
Seinen wenig schönen Namen trägt der Stickstoff mit Unrecht. Es ist wohl richtig, daß eine brennende Flamme oder ein atmendes Wesen in einer reinen Stickstoffatmosphäre nicht existieren können und unter Erstickungserscheinungen zugrunde gehen. Aber diese Erscheinungen werden nicht sosehr durch das Vorhandensein des Stickstoffs als durch das Fehlen des Sauerstoffs hervorgerufen. An sich ist der Stickstoff ein harmloses Gas, von dem wir bei jedem Atemzuge beträchtliche Mengen in die Lungen nehmen. Ohne seine Gegenwart würde der reine Sauerstoff die Oxydationsprozesse in unserem Körper so gewaltsam und schnell ablaufen lassen, daß wir in kürzester Zeit zugrunde gehen müßten. Er hätte also zweifellos einen besseren Namen verdient als den, den er nun einmal trägt.
Noch in weiterer Hinsicht ist der Stickstoff aber für unser Leben unentbehrlich. Das Stickstoffatom bildet neben Sauerstoff, Wasserstoff, Kohlenstoff und Schwefel einen der Bausteine in jedem Eiweißmolekül. Die Eiweiße aber sind wieder für den menschlichen und tierischen Organismus unentbehrlich, Wir können unsere Nahrungsmittel in drei große Gruppen teilen, in Fette, in Kohlenhydrate und in eiweißhaltige Nahrung. Die Nahrungsfette sind nicht mit den in der Kohlenstoffchemie behandelten fetten Kohlenwasserstoffen zu verwechseln. Während diese nur aus Kohlenstoff und Wasserstoff bestehen und für den menschlichen Körper unverdaulich, ja, geradezu giftig sind, bestehen die Nahrungsfette aus Kohlenstoff, Wasserstoff und Sauerstoff. Freilich sind auch in ihnen die Kohlenstoffatome reihenförmig gelagert, und man kann sie als höhere Oxydationsstufen der fetten Kohlenwasserstoffe betrachten.
Die Kohlenhydrate, z. B. Stärkemehl und Zucker, bestehen ebenfalls aus Kohlenstoff, Wasserstoff und Sauerstoff. Dabei kommen aber Sauerstoff und Wasserstoff immer im Verhältnis 1 : 2 vor, also in dem gleichen Verhältnis wie im Molekül des Wassers. Solange man sich daher nicht um die genauere Struktur der Kohlenhydrate kümmert, kann man sie als eine Verbindung des Kohlenstoffs und des Wassers auffassen. In Wirklichkeit kommt es aber auf diese Struktur sehr stark an. Beispielsweise besitzen die Moleküle der Stärke und des Zellstoffes, der Zellulose, genau die gleichen empirischen Formeln. Aber ihre Struktur ist beträchtlich verschieden, und der Zellstoff ist für den menschlichen Magen vollkommen unverdaulich, während Stärke und Zucker leicht und vollkommen verdaut werden. Die Eiweißstoffe schließlich enthalten außer den drei Grundstoffen der Fette und Kohlenhydrate auch noch Schwefel und Stickstoff.
Im menschlichen und tierischen Organismus dienen die Nahrungsstoffe nun zwei verschiedenen Aufgaben. Einmal arbeiten sie als reine Heizstoffe. Sie werden im Körper oxydiert oder verbrannt und liefern dabei die notwendige Energie, die sich unter anderem in der gegen die Umgebung erhöhten Körpertemperatur zeigt, und die für den Lebensprozeß unentbehrlich ist. Andererseits aber werden aus den Nahrungsstoffen vom lebendigen Körper auch die Bausteine genommen, um neue Zellen zum Ersatz für die durch den Lebensprozeß ständig verbrauchten Zellen aufzubauen. Als Brennmaterial kann nun jeder Nahrungsstoff dienen. Für den Erneuerungsprozeß verbrauchter Zellen kommen aber nur die Eiweiße in Betracht, da die aufzubauenden Zellen ja selbst aus Eiweißstoffen bestehen. Daraus folgt das durch die Praxis bestätigte Ergebnis. Man kann einen Menschen am Leben und bei guter Gesundheit erhalten, wenn man ihn nur mit eiweißhaltiger Nahrung füttert. Er geht aber rettungslos zugrunde, wenn ihm nur Fette und Kohlenhydrate gegeben werden. Ohne stickstoffhaltige Nahrung ist der Organismus eben nicht imstande, den natürlichen Verschleiß zu ersetzen, und stirbt ab. Daraus folgt die ungeheuere Wichtigkeit des Stickstoffs für alles Leben, denn das von Mensch und Tier Gesagte gilt sinngemäß geändert auch für das Pflanzenleben. Auch die Pflanze kann ohne Stickstoffnahrung keine Zellen bauen.

Fig. 30.
Eine brennende Kerze in atmosphärischer Luft.
Paraffin C24H50 + X·O = 24 CO2 + 25 OH2 Die Kerze brennt und liefert außer den beiden Verbindungen Kohlensäure und Wasserdampf auch noch Energie in Form von Wärme und Licht.
Wäre nun der Stickstoff chemisch ebenso regsam wie etwa der Sauerstoff, so würde sich sein Kreislauf im irdischen Leben sehr glatt vollziehen, und man hätte kaum Grund, von einem Stickstoffproblem zu sprechen. Aber der Stickstoff ist chemisch ungemein träge. Seine Verbindungen sind ausnahmslos endothermisch, d. h. man muß Energiemengen, und zwar recht beträchtliche Energiemengen, hinzufügen, wenn man ihn in eine Verbindung zwingen will. Lassen wir etwa eine Stearinkerze in einer Sauerstoffatmosphäre brennen, so erhalten wir eine sehr heiße Flamme, die uns eine beträchtliche Wärmeenergie liefert (Fig. 30). Wollen wir dagegen Stickstoff in einer Sauerstoffatmosphäre verbrennen, d. h. irgendeine Verbindung zwischen N und O herbeiführen, so müssen wir Energie hinzuführen. Die Stickstoffflamme ist nicht nur keine Energiequelle, sondern ein Energieverbraucher.
Den Weg, auf dem man unter Energiezufuhr den Stickstoff zur Verbindung mit dem Sauerstoff zwingen kann, zeigt uns die Natur selbst. Die gewaltigen elektrischen Entladungen, die im Verlaufe eines Gewitters als Blitzschläge austreten, führen unter Bindung von Blitzenergie stets zur Verbindung von Stickstoffatomen und Sauerstoffatomen der Atmosphäre. Da aber weiter jedes Gewitter mit Regengüssen verbunden zu sein pflegt, so geht die chemische Reaktion dabei in der Weise weiter, daß die gebildeten Stickstoffsauerstoffverbindungen sich mit den Wassermolekülen des in vielen Millionen feinster Tröpfchen durch die Atmosphäre rieselnden Regens zu Salpetersäure von der Formel HNO3 vereinigen (Fig. 31).

Fig. 31.
Die chemische Bindung des atmosphärischen Stickstoffes durch die Gewalt des Blitzes.
Der Blitzschlag, jene mächtige elektrische Entladung, schmiedet die Stickstoff- und Sauerstoffatome der Luft zu einem Oxyd von der Form N2O3 zusammen. Der beim Gewitter stets fallende Regen bringt Wasser von der Form H2O hinzu, und so bildet sich Salpetersäure, HNO3, die im Regen zur Erde strömt und den Boden fruchtbar macht.
Schon der alte Homer spricht von Schwefeldampf, der stets beim Blitzschlag auftritt. Dieser Schwefeldampf ist nichts anderes, als das beim Blitzschlag gebildete Stickoxyd, das einen scharfen, entfernt an Schwefeldampf erinnernden Geruch besitzt. Tatsache ist es, daß jeder Gewitterregen beigemengte Salpetersäure besitzt. Zwar ist der Prozentsatz der Säure im Verhältnis zum Wasser nur sehr gering. Da aber ein tüchtiger Gewitterregen ganz gewaltige Wassermengen im Betrage von vielen Tausenden von Kubikmetern ausschüttet, so ergeben sich dabei doch auch recht beträchtliche Salpetersäuremengen, die nun im Erdboden sofort salpetersaure Salze bilden und somit die geeigneten stickstoffhaltigen Nährstoffe für die Pflanzenwelt liefern.
Wenn wir an der Theorie einer allmählichen Abkühlung der Erde von hellster Rotglut bis zur heutigen Temperatur festhalten, so dürfen wir annehmen, daß fast alle in der Erdkruste vorhandenen Stickstoffverbindungen letzten Endes durch atmosphärische elektrische Entladungen zusammengeschweißt worden sind. Zweifellos hat es in den früheren Jahrmillionen der Erdgeschichte aber auch Gewitter gegeben, denen gegenüber die stärksten Tropengewitter unserer Tage harmlos erscheinen.

Fig. 32.
Solange die Besiedlung Europas verhältnismäßig dünn und die Ausnutzung des Ackerbodens weniger intensiv war, konnte man dem Kreislauf des Stickstoffs in der Natur seinen freien Gang lassen. Die Pflanzen entnahmen dem Boden die mineralischen Stickstoffverbindungen und bauten daraus im Pflanzenkörper die Pflanzeneiweiße auf. Die Pflanze diente dann ihrerseits als Nahrungsmittel für Tiere und Menschen. Im Tierkörper wurde das Pflanzeneiweiß weiter umgeformt, zu Fleisch und Blut verarbeitet. Als menschliche Nahrung machte der Tierkörper den gleichen Prozeß noch einmal durch. Letzten Endes kamen die stickstoffhaltigen organischen Verbindungen bei diesem Prozeß wieder als Dungstoffe auf den Acker und begannen den Kreislauf durch Pflanze und Tier von neuem. Gründlich zerstört wurden Stickstoffverbindungen dabei nur durch das Feuer. Wo man Pflanzenteile oder Leichen verbrannte, zerfielen die Stickstoffverbindungen wieder vollständig in ihre Elemente. Aber diesem Stickstoffverlust stand ja ein ständiger Neugewinn gegenüber. Einmal lieferten die Gewitter eines jeden Jahres einen fortlaufenden Strom von Salpetersäure. Außerdem aber gibt es gewisse Bodenbakterien, welche die wunderbare Fähigkeit besitzen, den freien Stickstoff chemisch zu binden und so ihrerseits den Boden mit Stickstoffverbindungen anzureichern. Solange die europäische Landwirtschaft noch in der Lage war, mit der Brache zu arbeiten, d. h. das Feld nach zwei Erntejahren wenigstens ein Jahr brachliegen zu lassen, genügten diese natürlichen Stickstoffzuflüsse, um das Gleichgewicht aufrechtzuerhalten.
Ich weiß eine friedliche Stelle
Im schweigenden Ozean,
Kristallhell schäumet die Welle
Zum Felsengestade hinan.
Im Hafen erblickst du kein Segel,
Keines Menschen Fußtritt am Strand;
Viel tausend reinliche Vögel
Hüten das einsame Land.
Sie sitzen in frommer Beschauung,
Kein einz'ger versäumt seine Pflicht,
Gesegnet ist ihre Verdauung
Und flüssig als wie ein Gedicht.
Die Vögel sind all' Philosophen,
Ihr oberster Grundsatz gebeut:
Den Leib halt' allezeit offen,
Und alles andre gedeiht.

Fig. 33.
Guanolager an der Südsee.
Da der einheimische Dünger nicht mehr langte, griff man zum ausländischen. Die Klippen und Inseln der Südsee, auf denen die Seevögel Dungablagen von 10 bis 20 m Stärke gebaut hatten, wurden systematisch ausgebeutet.
Etwa vom letzten Drittel des vorigen Jahrhunderts an wurde es jedoch notwendig, dem Ackerlande darüber hinaus Stickstoff zuzuführen, und gestützt auf die bahnbrechenden Arbeiten von Justus von Liebig griff man zur Kunstdüngung. In Chile in Südamerika fanden sich überreiche natürliche Salpeterlager. Jahraus, jahrein wanderten nun Millionen von Tonnen des Chilesalpeters über das Weltmeer nach Europa (Fig. 34-36). Im letzten Jahr vor dem Weltkriege hatte allein Deutschland eine solche Salpetereinfuhr im Werte von 100 Millionen Mark. Da aber die Landwirtschaft immer nur 1 Mark für das gebundene Kilogramm Stickstoff zahlte, so läßt sich leicht berechnen, daß die Jahreseinfuhr hunderttausend Tonnen gebundenen Stickstoffes umfaßte.
Schon um die Jahrhundertwende begann diese Entwicklung sowohl den Volkswirtschaftern als auch den Chemikern Sorge zu bereiten. So reich auch die chilenischen Salpeterlager waren, so ließ sich schließlich doch der Tag vorausberechnen, an dem sie einmal erschöpft sein mußten.

Fig. 34.
Sprengungen in den chilenischen Salpeterlagern.
(Chilesalpeter = NaNO3 = Natronsalpeter.)
Die Dynamitsprengung hat mächtige Blöcke aufgeworfen, die mit dem Hammer zerkleinert und auf den zweirädrigen Karren (Karreten) weiterbefördert werden.
Weiter aber hing bei dieser Entwicklung schließlich die Existenz aller Europäer von der Bereitwilligkeit der chilenischen Regierung ab, weiterhin Salpeter zu exportieren. Stickstoff hatte man in der Atmosphäre auch in Europa im Überfluß. Energie war zu jener Zeit, da man den elektrischen Ausbau der Wasserkräfte begann, ebenfalls vorhanden. Und so handelte es sich nur darum, geeignete Bindungsverfahren zu finden.
Die Natur zeigte einen Weg, der auch zunächst beschritten wurde. Man nahm den künstlichen Blitz, den elektrischen Hochspannungsfunken. Zwischen Metallelektroden ließ man den elektrischen Flammenbogen überspringen. Durch ein kräftiges magnetisches Feld wurde dieser Bogen zu einer flachen Flammenscheibe von mehr als 2 Meter im Durchmesser auseinandergezogen, und durch dieses 3000 Grad heiße elektrische Flammenfeld wurde ein geschlossener Luftstrom mit großer Geschwindigkeit hindurchgeblasen. Die einzelnen Luftteilchen werden dabei in Bruchteilen einer Sekunde auf 3000 Grad erhitzt und sehr schnell wieder abgekühlt. Die praktische Wirkung zeigt sich darin, daß die so elektrisierte Luft danach 2 Prozent Stickoxyd enthält. Das hier skizzierte Verfahren von Birkeland und Eyde kam besonders in Verbindung mit den norwegischen Wasserkräften zur Anwendung. Die elektrisierte Luft leitete man beim Verlassen des Ofens durch große, mit Kalklauge gefüllte Behälter, hier bildete das Stickoxyd mit dem Wasser zunächst Salpetersäure, und schon im Augenblicke ihres Entstehens verband sich diese mit dem Kalzium der Kalklauge zu einem salpetersauren Kalksalz, dem sogenannten Norgesalpeter (Fig. 38).

Fig. 35.
Anfuhr des Chilesalpeters (NaNO3) auf die Halden, von denen er maschinell per Bagger, Eisenbahn und Schiff weiterbefördert wird.

Fig. 36. In der deutschen Salpeterfabrik.
Der Chilesalpeter (Natronsalpeter = NaNO3) wird durch Behandlung mit den deutschen Kalisalzen in Kalisalpeter K2NO3 umgewandelt.
Der Norgesalpeter ist ein vorzüglicher Kunstdünger und wird auch heute noch an den skandinavischen Wasserkräften in großen Mengen gewonnen. Zur Anwendung in Deutschland eignete sich dies Verfahren wegen seines großen Energieverbrauches aber nicht. Die Stickstoffsauerstoffverbindungen kommen nämlich zwar in der hohen Temperatur des Lichtbogens zustande, aber sie zerfallen auch ebenso leicht wieder bei dieser Temperatur. Es muß sich deshalb immer darum handeln, die gebildeten Verbindungen so schnell wie möglich aus der Flammenzone herauszuholen. Vorbildlich arbeitet hier der natürliche Blitz, der nur wenige tausendstel Sekunden dauert, die Verbindung schafft, aber schon wieder verschwunden ist, bevor er sie zersetzen kann. Im Birkeland-Ofen dagegen ist der Wirkungsgrad viel schlechter, etwa 90 Prozent der wirklich gebildeten Stickstoffverbindungen zerfallen wieder, da sie nicht schnell genug abgekühlt werden können. Die deutsche Chemie hat deshalb andere Wege eingeschlagen, um die notwendigen Stickstoffmengen im eigenen Lande mit den hier verfügbaren Energiemengen zu binden, und sie hat dabei große Erfolge erzielt.
Das Stickoxyd ist nach der Formel NO zusammengesetzt. Da nun der Stickstoff entweder dreiwertig oder fünfwertig auftritt, so müssen wir annehmen, daß hier eine seiner Valenzen ungebunden bleibt. Etwas Derartiges wird nur selten beobachtet. Aber auch diese wenigen Fälle zeigen uns, daß die Valenztheorie, so glänzende Dienste sie uns namentlich in der Kohlenstoffchemie leistet, doch noch nicht völlig lückenlos ist. Auch die Struktur der übrigen Stickstoffsauerstoffverbindungen zeigen zum Teil solche Schwierigkeiten. Außer dem Stickoxyd NO kennen wir das Stickoxydul N2O, das Stickstofftrioxyd N2O3, das Stickstoffdioxid NO2, das Stickstofftetroxyd N2O4 und das Stickstoffpentoxyd N2O5. Alle diese gasförmigen Verbindungen sind endotherm und können explosionsartig zerfallen. Die in ihnen nicht gebundenen Stickstoffvalenzen machen sie zum Eingehen weiterer Verbindungen sehr geneigt. So bilden sie mit Wasser freiwillig Säuren, von denen fünf bekannt sind, die untersalpetrige Säure H2N2O2 die Nitrohydroxylaminsäure H2N2O3, die salpetrige Säure HNO2, die Salpetersäure HNO3 und die Übersalpetersäure HNO4. Werden in diesen Säuren die Wasserstoffatome durch Atome der Halogenen oder salzbildenden Elemente verdrängt, so entstehen die entsprechenden Salpetersalze. Auch diese Verbindungen sind immer noch mehr oder weniger endotherm und können unter geeigneten Umständen explosiv zerfallen. Ein Beispiel bietet das gewöhnliche Schießpulver, welches eine Mischung von Kohle, Schwefel und einem Salpetersalz ist.
Die zweite große Gruppe der Stickstoffverbindungen beruht auf der Vereinigung des Stickstoffatoms mit Wasserstoffatomen. Die bekannteste dieser Verbindungen ist das Ammoniak. Das Ammoniakmolekül besteht aus einem Stickstoffatom und drei Wasserstoffatomen. In dieser Verbindung ist der Stickstoff dreiwertig, seine Valenzen sind gesättigt, und dementsprechend stellt das Ammoniak eine für die Verhältnisse des Stickstoffes recht stabile und nicht explodierende Verbindung dar. Neben dem Ammoniak besitzen die vier anderen heute bekannten Wasserstoffstickstoffverbindungen hauptsächlich theoretisches Interesse, während das Ammoniak und seine zahlreichen Verbindungen für den Stickstoffkreislauf in der Natur von größter Bedeutung sind. Diese vier anderen Verbindungen sind das Hydrazin N2H4, die Stickstoffwasserstoffsäure und die Verbindungen der Stickstoffwasserstoffsäure mit Ammoniak, NH3⋅N3H und mit Hydrazin N2H4⋅N3H.
Das Ammoniak ist ein stechend riechendes Gas, welches vom Wasser gierig aufgesaugt wird. Diese wäßrige Lösung ist unter dem Namen Salmiakgeist wohlbekannt. Es ist das allgemein gebräuchliche Hausmittel gegen Mückenstiche. Während der Stickstoff im Ammoniak zweifellos dreiwertig ist, tritt er in dem einwertigen Radikal NH4, dem Ammoniumradikal, fünfwertig auf. Die Bildung dieses Radikals aus dem Ammoniakmolekül muß man sich also in der Weise vorstellen, daß das Ammoniakmolekül, während sein Stickstoffatom aus dem dreiwertigen in den fünfwertigen Zustand übergeht, noch ein Wasserstoffatom aufnimmt. Das so entstehende Ammoniumradikal zeigt eine bemerkenswert feste Bindung seiner Atome und verhält sich durchaus wie ein einwertiges Metall. Es bildet nicht nur genau dieselben Verbindungen wie die einwertigen Metalle Kalium, Natrium usw., sondern es geht auch mit dem Quecksilber eine amalgamartige Verbindung ein, wodurch sein metallartiger Charakter besonders deutlich wird.

Fig.37. Elektroofen mit Blasemagnet.
(Erste Versuchsanordnung von Siemens & Halske.)
Bringt man Schwefelsäure von der Form H2SO4 mit einwertigen Metallen zusammen, so werden die beiden Wasserstoffatome derselben durch zwei Atome des betreffenden Metalls ersetzt, und es ergibt sich das entsprechende schwefelsaure Metallsalz, beispielsweise aus Kalium und Schwefelsäure das Kaliumsulfat K2SO4. Das gleiche geschieht, wenn man Ammoniakgas durch verdünnte Schwefelsäure hindurchleitet. Während dabei der Stickstoff fünfwertig wird, entreißt das Ammoniakmolekül der Schwefelsäure ein Wasserstoffatom, bildet mit diesem ein Ammoniumradikal und tritt sofort an Stelle dieses Wasserstoffatoms in das Schwefelsäuremolekül ein. So entsteht das schwefelsaure Salz des Ammoniums, das Ammoniumsulfat von der Form (NH4)2SO4. Dies schwefelsaure Ammoniak ist nun aber ein äußerst wertvoller Stickstoffdünger. Es ist der schärfste Konkurrent des Salpeterdüngers, und aus Gründen, die nachstehend dargelegt werden, dürfte es den Salpeterdünger allmählich immer mehr verdrängen.
Der Chilesalpeter ist ein Natronsalpeter von der Form NaNO3. Man kann ihn als das Natriumsalz der Salpetersäure HNO3 definieren, indem in dieser ein Natriumatom an Stelle des Wasserstoffatoms getreten ist. Bei der Zersetzung und weiteren Verarbeitung des Chilesalpeters im Ackerboden bleibt nun notwendigerweise das Natrium in Form irgendwelcher Natronsalze zurück. Im allgemeinen ist aber unser Ackerboden mit Natronsalzen bereits überreichlich versehen und versalzen, während ihm das für das Pflanzenleben so unentbehrliche Kalium fehlt. Unter Zuhilfenahme der in Deutschland selbst gefundenen Kaliverbindungen, insbesondere des Sylvins von der Form KCl, pflegt man den Chilesalpeter daher vor dem Verbrauch erst in einen Kalisalpeter umzuwandeln. Man bringt den in Wasser aufgelösten Natronsalpeter mit einer Chlorkalilösung zusammen. Dabei findet ein Austausch der beiden Alkalimetalle Kalium und Natrium statt. Aus dem Chlorkalium KCl wird Chlornatrium ClNa oder Kochsalz, aus dem Natronsalpeter NaNO3 ein Kalisalpeter KNO3. Mit diesem Dungstoff bekommt der Acker dann gleichzeitig Kali und Stickstoff.
Es ist aber nicht uninteressant, einmal zu untersuchen, wieviel Gewichtsprozente Stickstoff der Kalisalpeter im günstigsten Falle enthalten kann. Auf Grund der Atomgewichte läßt sich das leicht feststellen. Das Molekül des Kalisalpeters enthält 1 Atom Kali mit dem Atomgewicht 40, 1 Atom Stickstoff mit dem Atomgewicht 14 und 3 Atome Sauerstoff mit dem Gesamtatomgewicht 3 × 16 = 48. In einer Salpetermenge von dem Gewichte 40 + 14 + 48 = 102 befinden sich demnach nur 14 Gewichtsteile Stickstoff. Auf Prozente umgerechnet, bedeutet dies, daß reiner Kalisalpeter 13,7 Gewichtsprozente Stickstoff besitzt. Die gleiche Rechnung läßt sich auch für das schwefelsaure Ammonium aufmachen. Das Molekül dieses Salzes enthält 4 Sauerstoffatome mit dem Gesamtgewicht 4 × 16 = 64, 1 Schwefelatom mit dem Gewicht 32, 8 Wasserstoffatome mit dem Gewicht 8 × 1 = 8 und 2 Stickstoffatome mit dem Gewicht 2 × 14 = 28. In 132 Gewichtsteilen enthält reines Ammoniumsulfat demnach 28 Gewichtsteile Stickstoff, oder umgerechnet, Ammoniumsulfat hat 21,2 Gewichtsprozente Stickstoff.

Fig. 38.
Anordnung in den neueren norwegischen Salpeteröfen.
Der Wechselstromlichtbogen zwischen den wagerechten Elektroden wird durch die Blasmagneten N-S zu einer gewaltigen glühenden Scheibe von mehr als 1 m Durchmesser auseinandergezogen.
Schon dieser höhere Stickstoffgehalt machte das Ammoniumsulfat zu einem besonders wertvollen Dungstoff, und man war deshalb immer mehr bemüht, das Ammoniak, wo immer es auftrat, zu fangen, an Schwefelsäure zu binden und der Landwirtschaft zuzuführen. Ammoniakgas wurde aber besonders bei der Verkokung von Steinkohle frei. Die Eiweißverbindungen der vorzeitlichen Pflanzenkörper, die im Laufe unendlicher Zeiträume die Steinkohle bildeten, waren schon bei dieser Kohlebildung in einfachere Stickstoffverbindungen zerfallen und lieferten schließlich in der Rotglut der Kokereiretorten einfache Ammoniakmoleküle. Das bei der Verkokung auftretende Steinkohlengas wird nun aber zum Zwecke der Reinigung mehrfach und kräftig gewaschen. Das Waschwasser schluckt natürlich begierig jedes Ammoniakmolekül, und so entstehen die bekannten Ammoniakwässer der Gasanstalten. Aus ihnen läßt sich durch Zufügung von Schwefelsäure das schwefelsaure Ammonium leicht gewinnen.
Die Entwickelung in dieser Richtung begann bereits in den siebziger Jahren des vorigen Jahrhunderts. Im Jahre 1895 wurden in deutschen Kokereien und Gasanstalten schon 80 000 Tonnen schwefelsaures Ammonium gewonnen. 1913, in dem letzten Jahre vor dem Weltkriege, war diese Zahl auf 460 000 Tonnen gestiegen, wovon 400 000 Tonnen von der Landwirtschaft aufgenommen, 60 000 Tonnen von der chemischen Industrie, insbesondere von der Farbstoffindustrie, weiterverarbeitet wurden. Mit diesen 400 000 Tonnen Ammoniumsulfat, die bei rund 20 Prozent Stickstoffgehalt 80 000 Tonnen Stickstoff enthielten, und mit den im gleichen Jahre im Chilesalpeter eingeführten 100 000 Tonnen Stickstoff war aber der Stickstoffhunger der deutschen Landwirtschaft noch längst nicht befriedigt. Auch die etwa 20 000 Tonnen Stickstoff, die in Form von Norgesalpeter und dem später noch genauer zu besprechenden Kalkstickstoff hinzukamen, reichten nicht aus. Es war unbedingt notwendig, noch stärker fließende Stickstoffquellen zu erschließen, und schon vor dem Weltkriege war diese Entwicklung in vollem Gange.
Ebenso wie man durch das elektrische Lichtbogenverfahren den Sauerstoff und Stickstoff zusammenschweißte, konnte man es ja auch versuchen, den Wasserstoff und Stickstoff unmittelbar in eine Ammoniakverbindung zu zwingen. Energetisch mußte dies Verfahren von Anfang an sehr viel günstiger erscheinen, als jedes Salpeterverfahren. Während nämlich alle Stickstoffsauerstoffverbindungen endotherm sind, also starke Energiezufuhr erfordern, ist die Ammoniakverbindung schwach exotherm, müßte also theoretisch wenigstens ohne jene gewaltigen Energiemengen herzustellen sein, durch die alle Salpeterverfahren so kostspielig werden. Unter den zahlreichen Chemikern, die sich nun mit der Ammoniaksynthese beschäftigten, muß als der bei weitem erfolgreichste der deutsche Forscher Geheimrat Haber genannt werden. Seine Arbeiten führten schon vor dem Kriege zu dem besonders von der Badischen Anilinfabrik weiterentwickelten Ammoniakverfahren, welches im Weltkriege die wertvollsten Dienste leistete.
Die Elemente Wasserstoff und Stickstoff vereinigen sich freiwillig zu Ammoniak, wenn eine gewisse Temperatur und ein gewisser Druck vorhanden sind und außerdem noch ein sogenannter Katalysator oder Kuppelstoff durch seine Gegenwart wirkt. In jahrelangen Forschungen ermittelte Haber, daß die günstigsten Temperaturen und Drucke bei etwa 500 Grad Celsius und 100 Atmosphären lagen, während feinverteiltes Uranmetall einen guten Katalysator abgab. Bei diesen Verhältnissen konnten sich in dem Wasserstoffstickstoffgemenge 10,8 Prozent Ammoniak bilden, bevor der Gleichgewichtszustand erreicht war, neugebildetes Ammoniak also im gleichen Tempo wieder zerfiel, in welchem es entstand. Es genügte, das Stickstoffwasserstoffgemenge mit mäßiger Geschwindigkeit unter den angegebenen Temperatur- und Druckverhältnissen an dem Katalysator vorbeizuführen, um diese günstigste 10prozentige Anreicherung zu erhalten.

Fig.39.
Großer Lichtbogenofen für die Bindung des Luftstickstoffes.
Viel bedeutender waren die technischen Schwierigkeiten. 500 Grad Celsius ist bereits die Temperatur der beginnenden Rotglut, bei der die Festigkeit aller Metalle recht bedeutend nachläßt. Es bedurfte daher besonderer Kunstgriffe, um Gefäße und Röhrensyteme zu schaffen, welche der gleichzeitigen Einwirkung dieser Temperaturen und Drucke gewachsen waren. Eine Quelle weiterer Schwierigkeiten bildete der Katalysator. Es ergab sich, daß er gegen »Vergiftungen« durch äußerst geringfügige Zufuhr bestimmter Stoffe, wie beispielsweise des Arsens, äußerst empfindlich war. Wollte man einen zuverlässigen und rationell arbeitenden Betrieb erreichen, so mußten deshalb die Rohstoffe des Verfahrens, Stickstoff und Wasserstoff, auf das sorgfältigste von diesen Katalysatorgiften freigehalten werden. Es gelang namentlich durch vorherige Ausscheidung des Arsenwasserstoffes, der sich spurenweise immer in dem aus Steinkohlen gewonnenen Wassergas zu finden pflegt, und schon vor dem Kriege kam die Ammoniaksynthese nach dem Haber-Verfahren in Deutschland in großem Stile zur Ausführung.
Während des Krieges selbst waren diese synthetischen Stickstoffverbindungen für das von aller Zufuhr abgeschnittene Deutschland von größter Wichtigkeit. Nur mit ihrer Hilfe konnten die ungeheuren in den Schlachten des Weltkrieges verbrauchten Sprengstoffmengen hergestellt werden, von gleicher Wichtigkeit waren sie aber auch für die Ernährung des deutschen Volkes. Dabei wurde durch die Not des Krieges auch eine Erfindung gezeitigt, die besondere Erwähnung verdient. Es wurde bereits gesagt, daß die Pflanze imstande ist, die einfachen Stickstoffverbindungen, wie Salpetersalze und Ammoniumsulfat, aufzunehmen und zu assimilieren, d. h. daraus Pflanzeneiweiß aufzubauen. Dagegen vermag der tierische und menschliche Organismus mit diesen einfachen Verbindungen nichts anzufangen. Sie müssen erst durch den Pflanzenkörper gehen, bevor sie für die Ernährung von Menschen und Tieren in Betracht kommen können. Die Chemie war ihrerseits noch nicht so weit, solche Eiweißstoffe in der Retorte herzustellen. Wohl aber war die Biologie in der Lage, einfachste Lebewesen, besondere Spaltpilze oder Bakterien zu züchten, die dem Chemiker vorläufig die Eiweißsynthese abnehmen konnten.
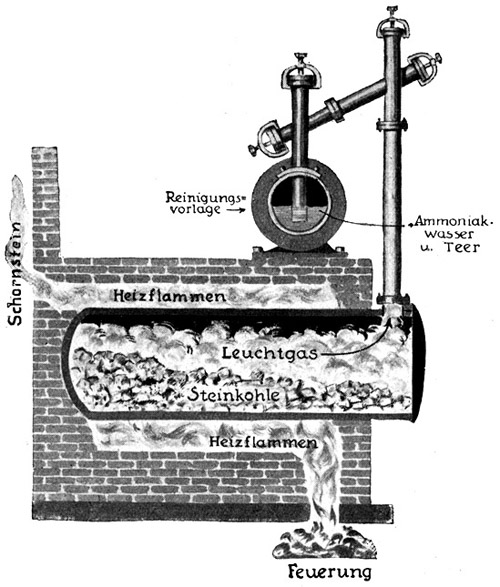
Fig. 40.
Ammoniak (NH3)-Gewinnung bei der Vergasung der Steinkohle.
Das Bewundernswerte dabei liegt in dem Umstande, daß der Mensch hier gewissermaßen als Schöpfer auftritt, daß er ganz neue, bis dahin noch nicht vorhandene Organismen züchtet, die unter ganz bestimmten vorgeschriebenen Bedingungen leben und für ihn arbeiten. Die während des Krieges gezüchteten Eiweißbakterien lebten auf einem Nährboden, der aus schwefelsaurem Ammonium, Rübenzucker und Wasser bestand. Von den fünf Bausteinen des Eiweißes: Kohlenstoff, Sauerstoff, Wasserstoff, Stickstoff und Schwefel, fanden sie den Schwefel und Stickstoff in einer ihnen zusagenden Form im schwefelsauren Ammonium, die drei anderen Stoffe im Zucker, der ja ein Kohlehydrat ist.
So bauten sie aus diesen ihnen in dem Nährboden gegebenen Stoffen bei einem äußerst üppigen Wachstum Eiweiß auf, welches sich als gut geeignet für die menschliche Ernährung erwies. Im Verlaufe weniger Tage war der mit einer Kultur dieser Bakterien geimpfte Nährboden verzehrt, dafür aber war die Bakterienmenge entsprechend vergrößert, und die Körper dieser Bakterien bestanden ausschließlich aus gutem Eiweiß. Das Ganze war eine praktisch und wirtschaftlich lohnende Eiweißsynthese mit biologischen Hilfsmitteln. Der Prozeß ging schnell und ohne Verluste vonstatten. Stickstoff, der heute noch frei in der Atmosphäre flutete, und Schwefel, der noch in der Schwefelsäure steckte, konnten bereits am nächsten Tage mit Kohlenstoff und Wasser Eiweißmoleküle bilden. Geopfert mußte dabei ein aus der Pflanzenwelt stammendes Nahrungsmittel werden, nämlich Rübenzucker. Aber als reines Kohlehydrat hat der Zucker nur Heizwert, während das auf dem hier geschilderten Wege aus ihm gewonnene Eiweiß ein Nahrungsmittel ist, welches nicht nur als Heizmittel, sondern auch als Mittel zum Aufbau neuer Körperzellen wirkt. Darin lag die große Bedeutung dieses Verfahrens.
Neben den beiden Wegen, den Luftstickstoff an den Sauerstoff oder an den Wasserstoff zu binden, muß auch noch ein dritter, viel benutzter Weg besprochen werden. Es ist das sogenannte Kalkstickstoffverfahren, welches namentlich vor der Erfindung Habers das einzige in Deutschland selbst in Frage kommende Verfahren war. Dies Verfahren braucht mehr Energie als das Habersche Ammoniakverfahren, aber doch nicht solche Energiemengen wie das Lichtbogensalpeterverfahren. Der Ausgangsstoff ist hierbei das Kalziumkarbid, eine Verbindung des Kalziummetalls und des Kohlenstoffs von der Form CaC2. Das Kalziumkarbid wird im elektrischen Ofen bei einer Temperatur von 3000 Grad unmittelbar aus Koks und Kalk zusammengeschmolzen. Es verlohnt sich, an diesem Beispiel einmal die Abhängigkeit der chemischen Verwandtschaften von der Temperatur zu beobachten.
Wir gehen von drei Stoffen aus, dem Kohlenstoff, dem Sauerstoff und einem Metall. Bei gewöhnlicher Raumtemperatur von 15 Grad Celsius herrscht eine merkliche Verwandtschaft zwischen den meisten Metallen und dem Sauerstoff. Ihre blanke Oberfläche beschlägt sich infolge von Oxydbildung verhältnismäßig schnell. Dagegen bleibt der Kohlenstoff bei dieser Temperatur Jahre hindurch unverändert. Erhöhen wir aber die Temperatur bis zur beginnenden Rotglut, so zeigt auch der Kohlenstoff eine starke Verwandtschaft zum Sauerstoff, die bei noch weiterer Temperaturerhöhung stärker wird als diejenige zwischen dem Metall und dem Sauerstoff. Aus diesem Grunde wirkt der Kohlenstoff bei heller Rotglut auf die Metalle reduzierend. Er entreißt etwa vorhandenem Metalloxyd den Sauerstoff und verbrennt damit zu Kohlensäure. Wieder anders werden aber die Verhältnisse, wenn wir die Temperatur noch höher, bis auf 3000 Grad, steigern. Dann zeigt sich eine starke Verwandtschaft zwischen dem Kohlenstoff und dem Metall. Der Kohlenstoff bildet mit diesem Metallkarbid, und nur bei einem Überschuß von Kohlenstoff kommt der Sauerstoff noch in die Lage, mit diesem Kohlensäure zu bilden. Auf diesen mit steigender Temperatur wechselnden Verwandtschaften der Elemente beruht die Kalziumkarbidgewinnung im elektrischen Ofen.
Das Kalziumkarbid wird nun fein gemahlen, danach auf helle Rotglut erhitzt, während man Stickstoff in die glühende Masse hineinleitet. Dabei wird aber der sonst so träge Stickstoff bemerkenswerterweise aktiv. Er wandert in das Kalziumkarbidmolekül ein und bildet Kalziumzyanamid. Dabei fällt ein Kohlenstoffatom heraus, so daß schließlich ein Gemisch von Kalziumzyanamid und Kohlenstoff vorhanden ist, eine Masse, die in der Landwirtschaft unter der einfacheren Bezeichnung Kalkstickstoff als wertvolles Düngemittel eine große Bedeutung hat. Der chemische Vorgang zwischen dem rotglühenden Kalziumkarbid und dem Stickstoff vollzieht sich dabei nach der folgenden chemischen Gleichung:
CaC2 + N2 = CaCN2 + C.
Kalziumkarbid + Stickstoff = Kalziumzyanamid + Kohlenstoff, d. h. Kalkstickstoff
Der Kalkstickstoff kommt im Ackerboden mit dem Regenwasser in Berührung, und alsbald setzt eine neue Reaktion ein, bei welcher der Kalkstickstoff nach der nachstehenden Formel in kohlensauren Kalk und in Ammoniak zerfällt:
CaCN2 + 3 H2O = CaCO3 + 2NH3
Kalkstickstoff + Wasser = Kohlensaurer Kalk + Ammoniak
Das Ammoniak wird dabei zunächst von dem Wasser festgehalten und geht weiterhin mit den im Ackerboden vorhandenen Mineralien Ammoniumverbindungen ein, die von den Pflanzen gut verarbeitet werden. Im Wege der natürlichen Entwicklung wirkt also der Kalkstickstoff schließlich als Ammoniakdünger ganz ähnlich wie das Ammoniumsulfat. Während dieses neben dem Stickstoff dem Ackerboden auch noch den für den Aufbau von Eiweißen unentbehrlichen Schwefel zuführt, bringt der Kalkstickstoff den ebenfalls unentbehrlichen Kalk in den Boden. Das Verhalten des Kalkstickstoffs im Ackerboden ist bemerkenswert, weil man bei dem Worte Zyanamid unwillkürlich an Zyankali und sonstige sehr giftige Verbindungen denkt.
In der Tat lernen wir im Kalkstickstoff als einem Teil seines Moleküls das Zyanradikal kennen. Es ist nach der Form –C≡N zusammengesetzt. Der vierwertige Kohlenstoff hält mit drei Valenzen den dreiwertigen Stickstoff und behält eine Valenz frei. Das Zyan ist also ebenso wie das Ammonium ein einwertiges Radikal. Es ist sehr haltbar und benimmt sich, genau wie das Ammonium, in den verschiedenen Verbindungen durchaus wie das Atom eines einwertigen Elementes. Man bringt dies auch vielfach äußerlich zum Ausdruck, indem man es in seinen Verbindungen nicht als CN, sondern als Cy bezeichnet, als ob es ein Element mit dem Namen Zyan wäre.
Mit dem Wasserstoff verbindet sich das Zyan nach der Formel HCN zu einer Säure, die unter dem Namen Blausäure als eins der stärksten Gifte bekannt ist. Die Blausäure tötet nicht nur tierische, sondern auch pflanzliche Organismen schnell und gründlich. Würde also der Kalkstickstoff bei seiner Zersetzung im Ackerboden auch nur Spuren von Blausäure entwickeln, so wäre er als Dungstoff unmöglich. An Stelle des Wasserstoffs kann an das Zyanradikal natürlich auch irgendeins der einwertigen Alkalimetalle herantreten, und so entstehen die ebenfalls ungemein giftigen Zyansalze, wie Zyankalium und Zyannatrium. Diese Salze werden für manche industriellen Zwecke benötigt. Gingen doch die Arbeiten, die schließlich zur Herstellung des Kalkstickstoffes führten, ursprünglich von der Absicht aus, Zyankali in großem Maßstabe und möglichst billig herzustellen.
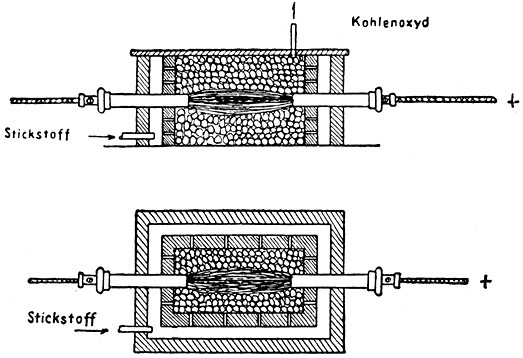
Fig. 41.
Elektrischer Widerstandsofen der Zyanid-Gesellschaft für direkte Kalk-Stickstoff-Gewinnung.
Während die Landwirtschaft nicht mehr als 1 Mark für das im Stickstoffdünger gebundene Kilogramm Stickstoff zahlt, ist die Industrie in der Lage, bis zu 8 Mark auszugeben, sofern der Stickstoff in der gewünschten Verbindung geliefert wird. Es ist begreiflich, daß die Chemie daher besonders eifrig bemüht war, die Wünsche der Zyankali benötigenden Industrien zu erfüllen. Der Kalkstickstoff hat sich dabei als recht wertvoll erwiesen. Es genügt, ihn mit Kochsalz zusammenzuschmelzen, um seinen gesamten Zyangehalt in Zyannatrium überzuführen. Das Zusammenschmelzen mit einem Kalisalz liefert entsprechend Zyankali. Die Laugen dieser Salze waren bis um die Jahrhundertwende eigentlich nur für photographische und galvanoplastische Zwecke in Gebrauch. Der Bedarf war daher nicht allzu groß. Dann aber änderten sich die Verhältnisse infolge der südafrikanischen Minenindustrie.
Die Goldgewinnung in Südafrika erfolgt aus dem Urgestein. Während die Goldwäscher anderer Länder hauptsächlich alluviales Gold suchen, das vom Wasser bereits aus seinem Urgestein herausgewaschen ist, verarbeitet man in Südafrika gerade dies Urgestein, einen harten, quarzhaltigen Felsen. Da das Gold in Form feinster Stäubchen in den Fels eingesprengt ist, so muß das ganze Gestein möglichst fein zerpocht werden. Danach ist das Gold aus dem sandförmigen Pochgut herauszuziehen. Man benutzte dazu Quecksilber, über welches das Pochgut mit Wasser hinweg geschwemmt wird. Soweit die Goldstäubchen dabei mit dem Quecksilber in Berührung kommen, verbinden sie sich mit ihm zu Goldamalgam und bleiben in ihm haften. Aber auch bei den besten Einrichtungen kommen nicht alle Goldstäubchen mit dem Quecksilber in Berührung.
Man verarbeitet in Südafrika goldführendes Gestein bis hinab zu etwa 12 Gramm Gold in der Tonne Pochgut. Aber davon bleiben auch bei bester Amalgamierung immer noch 1 bis 2 Gramm in dem Pochgut zurück. So hatten sich im Laufe der Jahre ganze Berge von verarbeitetem Pochgut, die sogenannten Sande und Schlamme aufgehäuft, von denen man wußte, daß sie noch sehr erhebliche Goldmengen enthielten. Hier bot nun die Zyankalilauge das geeignete Mittel. Läßt man diese Lauge durch die Sande und Schlamme laufen, so löst sie das darin enthaltene Gold fast bis auf die letzten Spuren auf und führt es mit sich. Bringt man später Zinkspäne in die Lauge, so schlägt sich das Gold auf diesen nieder und kann im Schmelzofen leicht gewonnen werden. So begann man denn Millionen von Kubikmeter dieser Sande mit Zyankalilauge zu bearbeiten, gewann dabei tonnenweis Gold, was sonst verloren gewesen wäre, brauchte aber auch riesenhafte Zyankalimengen. Auf dem Wege über den Kalkstickstoff wurden diese Mengen wirtschaftlich erzeugt, und vor dem Kriege war Deutschland der Hauptlieferant dafür nach Südafrika.
Betrachtet man die Entwicklung der Stickstoffchemie während der letzten 30 Jahre, so kann man geradezu von einer Geschichte dieses Elementes sprechen: Die europäischen Staaten erkennen in den letzten Jahren des vorigen Jahrhunderts die Notwendigkeit, sich vom amerikanischen Salpeter unabhängig zu machen. Europa selbst verfügt aber über natürliche Stickstoffverbindungen fast gar nicht. So muß man zum reinen Stickstoff der Atmosphäre greifen. Die skandinavischen Länder mit ihren überreichen Wasserkräften taten dies als die ersten unter Benutzung der Lichtbogenverfahren. In Deutschland war jedoch etwas Derartiges ausgeschlossen, und so beginnt hier die Suche nach anderen, wirtschaftlicheren, Wegen und führt auf der einen Seite zum Haberschen Ammoniakverfahren, auf der anderen Seite zum Kalkstickstoff und den Zyanverbindungen.
Der Weltkrieg stört zunächst die reine Forschungsarbeit, aber die sofortige energische Ausnutzung des bereits Erfundenen setzt Deutschland in die Lage, vier Kriegsjahre hindurch seinen Stickstoffbedarf im eigenen Lande zu decken. Im Lande selbst entstehen riesenhafte Kalkstickstoff- und Ammoniakwerke, die den Munitionsfabriken phantastische Mengen von stickstoffhaltigen Sprengstoffen liefern und den Stickstoffbedarf der Landwirtschaft decken. Als die bekanntesten dieser Kriegswerke mögen nur die Leunawerke bei Merseburg genannt werden.
Nach Kriegsende stehen alle diese Werke da. Für die Sprengstoffabrikation kommen sie, wenigstens zurzeit, nicht in Frage. Desto wertvoller sind ihre Leistungen und Lieferungen dagegen für die Landwirtschaft. Mit ihrer Hilfe wird es möglich, in den Nachkriegsjahren eine intensive Bodenkultur zu treiben, durch die auch das verkleinerte und seiner besten Getreideländer beraubte Deutschland den bei weitem größten Teil seines Nahrungsbedarfes im Inlande zu decken vermag. Soweit ist die Entwicklung gegenwärtig gediehen. Aber die Geschichte der Stickstoffchemie ist längst noch nicht abgeschlossen. Die Versuche, auf wirtschaftlichstem Wege vom Luftstickstoff zum eiweißhaltigen Futtermittel zu gelangen, werden auch heute fortgesetzt und lassen baldige Erfolge erhoffen.