
|
||||||||||||||
| Autoren | ∞ | Werke | ∞ | Neu | ∞ | Information | ∞ | Shop | ∞ | Lesetips | ∞ | Textquelle | ∞ | |
Anzeige. Gutenberg Edition 16. 2. vermehrte und verbesserte Auflage. Alle Werke aus dem Projekt Gutenberg-DE. Mit zusätzlichen E-Books. Eine einmalige Bibliothek. +++ Information und Bestellung in unserem Shop +++
Die griechische Naturphilosophie – Die dualistischen Systeme – Aristoteles und die peripatetischen Elemente – Die Elemente der Alchimisten – Ehrenrettung des Steins der Weisen – Der neue Elementenbegriff von Jungius und Boyle – Erhaltung der Elemente – Die Atomhypothese und ihre unerledigte Schwierigkeit – Stoffe –Bestimmtheit der Eigenschaften – Die Phlogistontheorie – Die Gewichtsverhältnisse; Lavoisier – Atavistische Erscheinungen – Begriff des Elements – Die Phase – Reine Stoffe und Lösungen – Andere Definition des Elements – Transmutation der Elemente beim Radium – Die chemische Weltenuhr
Bereits bei den ersten Versuchen der westeuropäischen Menschheit, die Mannigfaltigkeit der Erlebnisse zusammenfassend zu begreifen, tritt ein Gedanke auf, der seitdem in der Chemie seine hauptsächliche Stelle gefunden und behalten hat. der Gedanke der Elemente. Thales, der Begründer der Ionischen Naturphilosophie und damit der griechischen und europäischen Philosophie überhaupt, stellte als allgemeines Prinzip seiner Weltauffassung den Satz hin, dass alles aus Wasser entstanden sei. Die beiden hierin enthaltenen Gedanken, dass erstens die Dinge nicht allezeit so gewesen sind, wie wir sie jetzt vorfinden, und dass zweitens ihre Mannigfaltigkeit sich auf einfachere Grundlagen zurückführen lässt, sind seitdem massgebend für die spätere Gestaltung der Wissenschaft geworden. Der erste Gedanke spielt gegenwärtig seine wesentliche Rolle in der Biologie, wo der Begriff der zeitlichen Entwicklung sich als überaus fruchtbar für das Verständnis der vorhandenen Tatsachen erwiesen hat. Der zweite Gedanke, der des Elements oder Grundstoffes, beherrscht dagegen die anorganischen Wissenschaften, die Chemie und die Physik. Während in der Chemie er sich zu dem sehr bestimmten Begriff des chemischen Elements seit mehr als einem Jahrhundert ausgestaltet hat – eine Entwicklung, deren Betrachtung wir uns alsbald in erster Linie zuwenden wollen – stellt sich für die Physik ein noch allgemeinerer Begriff für ein Grundprinzip heraus, der bisher noch nicht zu vollständiger Anerkennung seiner Stellung gelangt ist. Es ist der Begriff der Energie, welchen wir als den allgemeinsten und daher elementarsten erkennen, welcher den physischen Wissenschaften ihr Gepräge gibt. Die Energie ist allerdings kein wägbarer Grundstoff, wie die chemischen Elemente es sind, wohl aber ist sie ein messbarer Grund wert, für den wie für die chemischen Elemente ein Gesetz der Unerschaffbarkeit und Unvernichtbarkeit, also ein Erhaltungsgesetz in Geltung steht, und den wir in jedem einzelnen Gegenstande der physischen Wissenschaften als den zentralen Begriff vorfinden.
Wenn in irgendeiner Wissenschaft ein leitender Begriff zuerst aufgestellt worden ist, beschäftigt sich regelmässig die nachfolgende Kritik nicht etwa mit der Frage, ob die hier zuerst versuchte Begriffsbildung denn überhaupt richtig oder zweckmässig gewesen ist. Es liegt vielmehr in einer solchen ersten Begriffsbildung etwas so imponierend Schöpferisches, dass die Nachfolger die einmal errungene Form ohne weiteres beibehalten und ihre Kritik nur auf sekundäre Fragen richten. So haben Thales' Nachfolger und Konkurrenten keineswegs gefragt, ob es denn überhaupt möglich wäre, die Entstehung aller vorhandenen Dinge aus einem einzigen Elemente aufzuzeigen, sondern sie haben dies mit Thales ohne weiteres angenommen und ihrerseits nur nachzuweisen gesucht, dass das von Thales angegebene Wasser diesen Vorzug nicht haben kann. So wurde nacheinander das Feuer, der Geist, das Sein oder Werden usw. als Grundprinzip alles Vorhandenen angesehen, und jeder Philosoph bemühte sich, seine besondere Gestaltung des Grundgedankens von Thales als die einzig mögliche nachzuweisen.
Auf diese unitarischen Systeme folgten dann in der Erkenntnis, dass ein einziges Ding schwerlich die nötige Mannigfaltigkeit entwickeln könne, um die Mannigfaltigkeit der wirklichen Dinge darzustellen, zunächst die dualistischen Systeme, in welchen zwei ähnliche aber entgegengesetzte Prinzipien, wie gut und böse, Liebe und Hass durch ihre Wechselwirkung die Welt gebildet haben sollten. Auch diese erwiesen sich als ungenügend und so sehen wir schliesslich bei Aristoteles einerseits eine beginnende Rücksicht auf die Erfahrung, und andererseits eine noch weitere Mannigfaltigkeit der Prinzipien in Gestalt eines doppelten Dualismus auftreten. Da diese Anschauungen in der späteren Entwicklung des Elementenbegriffes eine sehr erhebliche Rolle gespielt haben, so gehen wir ein wenig näher auf sie ein.
Aristoteles, dem eine überaus mannigfaltige anschauliche Kenntnis der Naturgegenstände eigen war, hat zunächst zum Ausdrucke bringen wollen, dass man als die Grundlagen oder Elemente der natürlichen Dinge in erster Linie deren allgemeine Eigenschaften ansehen muss. Denn an ihren Eigenschaften erkennen und unterscheiden wir die Dinge. So suchte er nach Eigenschaften, die allen Dingen zukommen, und glaubte diese in Wärme und Kälte, Trockenheit und Feuchtigkeit gefunden zu haben. Diese Eigenschaften sind paarweise entgegengesetzt und befriedigten somit das stark entwickelte Symmetriebedürfnis, das wir bei fast allen Philosophen, von Aristoteles mit seinen Elementen bis auf Kant mit seinen Kategorientafeln beobachten können.
Verbindet man nun diese Eigenschaften paarweise, so erhält man nach den Regeln der Kombinatorik sechs Paare. Von diesen fallen aber zwei fort, da sie unvereinbare Verbindungen zweier entgegengesetzter Eigenschaften darstellen, und es bleiben vier Paare gemäss der nachfolgenden Tabelle übrig:
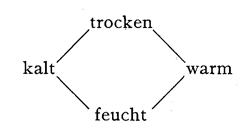
Als Typus des kalt und feuchten bezeichnete Aristoteles das Wasser, als Typus des kalt und trockenen die Erde, als Typus des feucht und warmen die Luft und als Typus des trocken und warmen das Feuer.
Dies ist der theoretische Ursprung der vier Aristotelischen oder peripatetischen Elemente, welche in den naturphilosophischen Betrachtungen des Mittelalters eine so grosse Rolle gespielt haben. Wie man sieht, sind es durchaus nicht Elemente in dem heutigen Sinne, d. h. durchaus nicht Stoffe, aus denen alle anderen Stoffe erzeugt oder hergestellt werden können. Als Elemente werden vielmehr bestimmte Eigenschaften angesehen, und die vier genannten Dinge sind nur Repräsentanten dieser Eigenschaften in ihren einfachsten Kombinationen. Durch die möglichen Abstufungen dieser Eigenschaften an den verschiedenen Dingen konnten die wirklichen Mannigfaltigkeiten der Natur einigermassen zum Ausdruck gebracht werden; wie vollständig, musste die spätere Forschung entscheiden.
Diese spätere Forschung, die nach dem Untergange der griechisch-römischen Kultur zunächst von den Arabern aufgenommen wurde, ergab zunächst, dass die von Aristoteles getroffene Wahl der elementaren Eigenschaften verunglückt war. Die chemischen Erfahrungen legten ganz andere natürliche Klassen nahe; insbesondere waren es die Metalle, die wegen ihrer technischen und wirtschaftlichen Wichtigkeit auch eine Stelle im wissenschaftlichen System beanspruchten. So verzichteten die arabischen Naturforscher auf die schöne Aristotelische Symmetrie und suchten eine bessere Darstellung ihrer Erfahrungen durch die Wahl anderer Typen. Zum Repräsentanten des metallischen Wesens wurde das Quecksilber ernannt, zum Repräsentanten einer anderen hochwichtigen Eigenschaft, der Verbrennlichkeit, der Schwefel. Die Erde wurde als zweckmässiger Typus für die nichtmetallischen Mineralien beibehalten und das Salz zur Darstellung der Löslichkeit in Wasser und der Wirkung auf den Geschmack und auf andere Stoffe zugefügt. Stets aber wurde bei diesen und ähnlichen Systemen betont, dass die genannten Elemente von den wirklichen Stoffen gleichen Namens streng zu unterscheiden seien, und dass der »philosophische« Schwefel und Quecksilber durchaus nicht mit gewöhnlichem Schwefel oder Quecksilber verwechselt werden dürften.
Dieser wissenschaftliche Standpunkt, demzufolge die Eigenschaften als das Elementare angesehen wurden, muss im Auge behalten werden, wenn man den Entwicklungsgang verstehen will, welchen die Chemie um jene Zeit nahm. Bekanntlich war es der Gedanke der künstlichen Herstellung des Goldes aus unedeln und wohlfeilen Metallen, welcher die Chemiker jener Zeit erfüllte. Wir sind jetzt gewohnt, auf die experimentellen Bemühungen des Mittelalters, jene Umwandlung zu bewirken, mit Verachtung als auf eine unbegreifliche Geistesverirrung herabzusehen. Doch haben wir hierzu ebensowenig Recht, wie gegenüber beispielsweise den modernen Versuchen zur künstlichen Herstellung der Eiweissstoffe. Denn der theoretische Standpunkt jener Zeit war durchaus der, dass es möglich sei, einem gegebenen Stoffe durch passende Operationen jede beliebige Eigenschaft zu erteilen, etwa wie wir es für möglich halten, jedes Element mit jedem beliebigen anderen zu verbinden. Erst die Erfahrung mehrerer Jahrhunderte ergab als Resultat, dass eine solche Umwandlung eines Metalls in ein anderes nicht ausführbar ist. Dies ist eine Tatsache der Erfahrung und hat als solche nichts mit logischen und aprioristischen Erwägungen zu tun; die künstliche Erzeugung des Goldes war für die Wissenschaft jener Zeit einfach ein technisches Problem, wie die künstliche Herstellung der Diamanten es für unsere Zeit ist.
Der Stein der Weisen, das Mittel, durch welches diese Umwandlung unedler Metalle in Gold sollte bewerkstelligt werden, spielt daher in der Geschichte der Chemie eine ganz ähnliche Rolle, wie die Erfindung des Perpetum mobile in der Geschichte der Physik. Und ebenso wie die Erkenntnis, dass ein Perpetuum mobile erfahrungsmässig unausführbar ist, zu der Entdeckung des Gesetzes von der Erhaltung der Energie, dem wichtigsten Fortschritte der physischen Erkenntnis des neunzehnten Jahrhunderts, geführt hat, so hat die Erkenntnis von der experimentellen Unmöglichkeit der Metallumwandlung zu dem Gesetze von der Erhaltung der Elemente geführt. Auch dieses ist ein Grundgesetz in der Chemie und hat als solches eine sehr grosse Bedeutung für die Systematik der chemischen Verbindungen; eine ähnliche allgemeine Bedeutung, wie jenes andere Gesetz hat es indessen noch nicht erlangt und es wird sie auch schwerlich erlangen.
Neben den erfolglosen Versuchen der Goldmacher oder Alchimisten gingen nun die Verbesserungen im Hüttenbetriebe, im Glasmachen und anderen Gewerben einher, die auf der Anwendung chemischer Vorgänge beruhen. Anderseits wurden die Ärzte auf die starken Wirkungen gewisser anorganischer Präparate, insbesondere der Quecksilber- und Antimonverbindungen aufmerksam, und so vermehrten sich von verschiedenen Seiten die chemischen Einzelkenntnisse in schnellem Fortschritte. Diesen Tatsachen gegenüber erwies sich auch der verbesserte Elementenbegriff der arabischen Chemiker als mehr und mehr unzulänglich. Die Versuche, ihn weiter zu verbessern, gingen zunächst denselben Weg, wie die früheren, indem die eigentliche Begriffsbildung beibehalten und nur den Tatsachen einigermassen besser angepasst wurde: so wurde fette und glasige Erde von der gewöhnlichen unterschieden. Daneben aber bereitete sich eine andere Auffassung vor, zu der die Erfahrungen unwiderstehlich hindrängten. Man lernte mehr und mehr die Gruppen zusammengehöriger Stoffe kennen, die sich von einem gegebenen Stoffe ableiten oder in ihn umwandeln lassen und erkannte in diesen natürliche Familien. Damit war ein Verständnis für die Tatsache gegeben, dass nicht jeder Stoff mit beliebigen Eigenschaften behaftet werden kann, sondern dass die letzteren ganz und gar davon abhängen, von welchen Stoffen man ausgeht. Danach konnte man auch nicht mehr die Eigenschaften als die Elemente oder Prinzipien betrachten, aus denen die Stoffe zusammengesetzt werden können, sondern man musste in den Stoffen selbst jene Elemente oder Prinzipien suchen, von denen die Beschaffenheit der Produkte abhängig ist.
Hierdurch verschob sich der Begriff des Elements mehr und mehr vom Abstrakt-Eigenschaftlichen ins Konkret-Stoffliche. Die Geschichte der Chemie nennt Robert Boyle (1627 bis 1691) als den Forscher, welcher in einem einflussreichen und vielgelesenen Werke »Chymista scepticus« den Grundsatz ausgesprochen und zur Geltung gebracht hat, dass man als Elemente nicht Eigenschaften, sondern Stoffe anzusehen habe, und zwar alle solche, die man nicht zerlegen, aus denen man aber die anderen Stoffe zusammensetzen kann. Doch hat die neuere Geschichtsforschung gezeigt, dass die gleichen Gedanken ein Vierteljahrhundert vor Boyle bereits von dem Hamburger Rektor Jungius ausgesprochen worden sind, wenn auch dessen Einfluss auf das Denken seiner Zeit- und Fachgenossen viel geringer geblieben war.
Man muss den hier gemachten Fortschritt sehr hoch anschlagen. Durch den Begriff der Zusammengesetztheit gewisser Stoffe, demgemäss z. B. Zinnober nicht nur aus Schwefel und Quecksilber hergestellt, sondern auch in Schwefel und Quecksilber umgewandelt oder »zerlegt« werden kann, ist nicht nur ein ausserordentlich wichtiges genetisches Verhältnis zwischen den verschiedenen Stoffen zur Darstellung gebracht, sondern es sind auch die quantitativen Betrachtungen vorbereitet, welche sich später als so einflussreich für die weitere Entwicklung der Chemie erweisen sollten. So wird, wenn man die Entwicklungsgeschichte der Chemie in Perioden einteilen will, die durch Jungius und Boyle erreichte Wendung als der eigentliche Beginn der neueren Chemie anzusprechen sein.
Das diesen Fortschritten zugrunde liegende Gesetz hat nur sehr langsam seinen vollständigen Ausdruck gefunden, obwohl es stufenweise praktisch bekannt wurde. Ebenso ist in späterer Zeit dieses Gesetz immer stillschweigend angenommen worden, ohne besonders formuliert zu werden; erst in neuester Zeit hat man begonnen, es ausdrücklich auszusprechen. Wir wollen dies Gesetz das von der Erhaltung der Elemente nennen. Es besagt folgendes: wenn irgendwelche chemischen Stoffe gegeben sind, und man bestimmt die Elemente dieser Stoffe der Art und Menge nach, so kann durch keinen Vorgang irgendwelcher Art an diesen Stoffen die Art und Menge ihrer Elemente geändert werden. Mit anderen Worten: die Elementaranalyse eines beliebigen chemischen Gebildes gibt stets dieselben Resultate, welche physikalischen oder chemischen Vorgänge man auch innerhalb dieses Gebildes vornehmen mag.
Dies ist offenbar eine sehr weitgehende Einschränkung der Vorstellungen, die vorher über die Beschaffenheit der Stoffe in Geltung waren. Wie wir gesehen haben, beruhten diese auf der Annahme, dass man jedem Stoffe durch passende Operationen jede beliebige Eigenschaft erteilen könne. Gerade die Erfahrungen der Alchimisten, dass dies in bezug auf die willkürliche Herstellung des Goldes nicht anging, brachten in diesem viel untersuchten Punkte die Erkenntnis zuwege, dass zur Gewinnung dieses Stoffes nur ganz bestimmte andere Stoffe benutzt werden können, nämlich nur solche, die später als Goldverbindungen bezeichnet worden sind, und keine anderen.
Die langsame Ausbildung dieser Erkenntnis beginnt etwa um die Mitte des siebzehnten Jahrhunderts und ist eine unmittelbare Folge der erweiterten experimentellen Kenntnis der chemischen Vorgänge. Insbesondere die Möglichkeit, die edeln Metalle wie Silber und Gold wieder aus ihren Umwandlungsprodukten, z. B. ihren Lösungen in Säuren, wieder herzustellen, wirkte nicht nur in dem Sinne dieser allgemeinen Erkenntnis, sondern auch noch in solchem Sinne, dass man diese Metalle in derartigen Umwandlungsprodukten trotz ihres Verschwindens als in gewissem Sinne fortbestehend annahm. Bei van Helmont (1577 bis 1644) finden sich zahlreiche Aussprüche in solchem Sinne, verbunden mit der weiteren wichtigen Erkenntnis, dass die zurückgewinnbaren Mengen der Stoffe gleich den zum Versuch genommenen sind. So wies er z. B. nach, dass man Kiesel mit Pottasche zu Glas schmelzen kann und aus diesem durch Zerlegung mit Säuren wieder das frühere Gewicht Kiesel erhält.
In gleichem Sinne arbeiteten Glauber, Sylvius de la Boë und andere; durch Boyle fanden, wie schon erwähnt, diese Ergebnisse der zunehmenden chemischen Kenntnisse ihren zusammenfassenden Ausdruck. Es liegt in der Natur der Sache, dass mit dieser Entwicklung auch das erste Auftreten einer analytischen Chemie im heutigen Sinne verbunden ist. Denn erst nachdem man im klaren war, dass die verschiedenen Stoffe den Produkten, die aus ihnen hergestellt sind (z. B. ihren Lösungen in Wasser oder Säuren), ganz bestimmte, von der Natur dieser Ausgangsstoffe abhängige Eigenschaften erteilen, konnte davon die Rede sein, ihr Vorhandensein mittelst solcher Eigenschaften zu erkennen.
Allerdings ist dieser wissenschaftliche Fortschritt zunächst nicht in reiner und allgemeiner Gestalt aufgefasst worden, was ja damals bei dem allgemeinen Jugendzustande der Wissenschaft noch gar nicht zu erwarten war, sondern er ist alsbald in die einigermassen willkürliche Form der Atom- oder Korpuskularhypothese geprägt worden, deren Anhänger auch Boyle war. Nimmt man an, dass die chemischen Verbindungen durch die Zusammenlegung der Atome der Elemente entstehen, so dass diese letzteren ihre »Natur« durch die Verbindung mit anderen nicht ändern, so muss man erwarten, dass man nur aus solchen zusammengesetzten Atomen, in denen die Atome bestimmter Elemente enthalten sind, diese für sich herstellen kann, und dass anderseits keine noch so willkürliche Änderung in dem gegenseitigen Verhältnis dieser elementaren Atome deren Natur und Anzahl verändern kann.
Wir erkennen hier den ersten Einfluss, welchen die hypothetischen Anschauungen über die Konstitution der »Materie«, d. h. der mit Gewicht und Masse ausgestatteten Komplexe auf die Erkenntnis der in ihnen waltenden Gesetze gehabt hat. Die ganze spätere Entwicklung der chemischen Wissenschaft hat unter dem Zeichen dieser Anschauungen gestanden, und die Mehrzahl der hier tätigen Forscher hat sich immer wieder geweigert, auf das Hilfsmittel derartiger hypothetischer Annahmen zu verzichten, so zweifellos die unsichere Beschaffenheit dieser Denkmittel war. Die Anschaulichkeit dieser Hypothesen ist immer wieder von ihren Anhängern als ihr unersetzlicher Vorzug ins Feld geführt worden. Das heisst, dass diese Denkmittel auf Grund der alltäglichen geometrischen und mechanischen Erfahrungen leichter gehandhabt werden, als hypothesenfreie, aber darum auch entsprechend abstraktere Fassungen der gleichen Gesetzmässigkeiten. Doch erinnert dieser Grund an die Entwicklung, welche jeder von uns beispielsweise bezüglich des Zahlenrechnens durchmacht. Anfangs glaubt man auch die Veranschaulichung mittelst der Finger nicht entbehren zu können, und die des Schreibens nicht kundigen russischen Händler führen mittelst des anschaulichen Hilfsmittels ihres Rechenbrettes ziemlich verwickelte Rechnungen mit grosser Sicherheit und Schnelligkeit aus. Aber derjenige, welcher sich mit abstrakteren und allgemeineren Rechnungsarten vertraut gemacht hat, wird sich bei schwierigeren Aufgaben, und insbesondere neuen Problemen gegenüber schliesslich doch als der freiere und daher leistungsfähigere Arbeiter erweisen.
Auch eine wesentliche Schwierigkeit, welche der atomistischen Anschauung anhaftet, hat Boyle nicht übersehen. Wenn nämlich die Atome in ihren Verbindungen unverändert fortbestehen, so sollte man erwarten, dass die Eigenschaften der Verbindungen die Summen, bezw. die sachgemäss gebildeten Mittelwerte von den Eigenschaften der Elemente sein müssten. Dass Boyle diesen Schluss aus der von ihm angenommenen Hypothese gezogen hat, geht daraus hervor, dass er wiederholt sein Erstaunen über das gegenteilige Verhalten der wirklichen chemischen Vorgänge ausspricht. So wundert er sich beispielsweise darüber, dass die auffallenden Eigenschaften der Säuren und Basen verschwinden, wenn sie sich zu Salzen vereinigen.
Diese Schwierigkeit der Atomhypothese ist bis auf den heutigen Tag nicht überwunden worden, wenn wir uns inzwischen auch derart an den Widerspruch gewöhnt haben, dass wir ihn kaum mehr als solchen empfinden. Wir begnügen uns mit allgemeinen Betrachtungen, dass die Eigenschaften der Stoffe irgendwie mit veränderlichen Bewegungs- oder Schwingungsverhältnissen der Atome zusammenhängen mögen, und dass durch die Verbindung mehrerer Atome untereinander diese Bewegungen geändert werden. Aber zu irgendwelchen exakten oder allgemeinen Ergebnissen haben derartige Betrachtungen bisher nicht geführt. –
Gleichzeitig mit der Klärung und Feststellung des Begriffes Element erfolgte die des Begriffes Stoff.In der Aristotelischen Philosophie war Stoff oder Materie das Indifferente, das je nach Umständen mit den verschiedensten, beliebigen Eigenschaften behaftet werden konnte. Durch die Feststellung, dass keineswegs jeder beliebige Stoff aus jedem beliebigen anderen hergestellt werden konnte, sondern dass dabei ganz bestimmte, beschränkte Verhältnisse obwalteten, ergab sich ein viel engerer Zusammenhang zwischen Stoff und Eigenschaft: die Art des Stoffes bedingt die Art der Eigenschaft.
Es besteht kein Zweifel, dass man die chemischen Spezies, die man seit vorgeschichtlicher Zeit zu unterscheiden begonnen hatte und deren Verschiedenheit man durch entsprechend verschiedene Namen festlegte, zunächst ebenso unbestimmt und unscharf aufgefasst hat, wie etwa die Spezies der Pflanzen und Tiere. Daher die grossen Schwierigkeiten, in der alten Literatur festzustellen, welche Stoffe unter den überlieferten Namen zu verstehen sind. Blei und Zinn sind beispielsweise noch von den Römern als wesentlich gleich angesehen und von Plinius als »schwarzes« und »weisses« Blei wie kleine Varietäten desselben Stoffes beschrieben worden.
Wie schwer es war, an gleichen Stoffen, die auf verschiedenem Wege hergestellt waren, ihre Gleichheit, und an ähnlichen Stoffen ihre Verschiedenheit zu erkennen, lehrt die Geschichte der alkalischen Karbonate. Bis in den Anfang des achtzehnten Jahrhunderts findet sich das Kaliumkarbonat mit verschiedenen Namen bezeichnet, je nachdem es aus Asche, aus Weinstein oder aus Salpeter hergestellt worden war. Umgekehrt waren bis dahin Pottasche und Soda wegen ihrer meist übereinstimmenden Reaktionen als nicht wesentlich verschieden angesehen worden. Erst Stahl bemerkt gelegentlich, dass im Kochsalz eine andere Basis enthalten zu sein scheine, als in der Pottasche, da die damit erhaltenen Salze gleicher Säuren verschiedene Kristallform und verschiedene Löslichkeit in Wasser aufweisen. Hier etwa haben wir also geschichtlich die Anfänge des allgemeinen Gedankens zu suchen, dass verschiedene Stoffe durch verschiedene Eigenschaften derart gekennzeichnet sind, dass bestimmte Werte der Eigenschaften sich stets in gleicher Weise und gleichem Betrage an gleichen Stoffen vorfinden, unabhängig von deren Darstellungsweise.
Allerdings fehlte noch viel an der Erkenntnis von der ganz bestimmten Beschaffenheit dieser Eigenschaften. Umgekehrt finden sich zahlreiche Zeugnisse dafür, dass je nach der Herstellungsweise Qualitätsunterschiede sogar bei elementaren Stoffen, wie Gold, Eisen, Zinn ebenso angenommen wurden, wie bei Brot, Wein und anderen willkürlich herstellbaren Produkten. Wann und wie dann die allgemeine Erkenntnis entstand, dass diese Verschiedenheiten der chemischen Substanzen von der Anwesenheit kleiner Mengen anderer Stoffe herrühren, und dass die Eigenschaften um so unabhängiger von der Herkunft werden, je vollständiger derartige fremde Stoffe beseitigt werden, scheint bisher noch nicht der Gegenstand einer eingehenden geschichtlichen Untersuchung gewesen zu sein. Jedenfalls war aber eine solche Erkenntnis am Ende des achtzehnten Jahrhunderts vorhanden. Denn um diese Zeit definierte die Mass- und Gewichtskommission der französischen Republik das Gramm als das Gewicht von einem Kubikzentimeter reinem Wasser bei +4° C; die Mitglieder dieser Kommission waren also nicht im Zweifel, dass dieses Gewicht übereinstimmend gefunden werden würde, auf welche Weise man auch das reine Wasser hergestellt haben möge.
Die Entwicklung dieser Erkenntnis war gleichbedeutend mit der Entwicklung des Unterschiedes zwischen einer Lösung und einem reinen Stoffe. Allerdings ist auch noch heute diese Unterscheidung meist als halb unbewusster Bestandteil der chemischen Praxis vorhanden und die grundsätzliche Festlegung der entsprechenden Begriffsbildung gehört der neuesten Zeit an. Immerhin betrachtet aber seit mehr als einem halben Jahrhundert beispielsweise der Organiker sein neu entdecktes Präparat so lange als »unrein«, als er noch eine Änderung des Siedepunkts beim gebrochenen Destillieren oder eine solche des Schmelzpunktes beim gebrochenen Kristallisieren beobachten kann. Dass aber derartige Veränderlichkeiten der Eigenschaften das spezifische Kennzeichen der Lösungen und ihre Unveränderlichkeit das der reinen Stoffe ist, findet man weniger oft und bestimmt ausgesprochen, als der Wichtigkeit der Sache wegen nötig wäre. Der Satz gehört zu den »selbstverständlichen«, über welche man weiter nicht nachzudenken pflegt.
Doch diese Betrachtungen führen uns auf Gedankengänge, die der neuesten Zeit angehören. Ehe wir uns tiefer in sie versenken, sind noch einige andere Entwicklungslinien zu betrachten, welche die gegenwärtige Begriffsbildung über Elemente und Verbindungen eingeleitet haben. Es sind die Versuche, welche dahin zielen, die grundsätzlich erkannte gegenseitige Abhängigkeit der Stoffe voneinander bezüglich ihrer Darstellung und Umwandlung in Gestalt allgemeiner Gesetze festzustellen.
Der wichtigste Fortschritt in der Erkenntnis der gegenseitigen Zusammenhänge zwischen den Stoffen wurde durch die Aufstellung der Verbrennungstheorie gemacht. Die Erfahrung zeigte, dass man die Eigenschaft der Verbrennlichkeit durch stoffliche Reaktionen einem gegebenen Gebilde mitteilen und entziehen kann. Kohle, welche selbst verbrennlich ist, erteilt vielen Stoffen, insbesondere den »Metallkalken« die Eigenschaft, ihrerseits verbrennlich zu werden, was mit dem gleichzeitigen Auftreten der metallischen Eigenschaften verbunden ist. Die Kohle selbst verschwindet dabei oder vermindert sich. Entsprechend der überkommenen Gewohnheit, für bestimmte Eigenschaften einen stofflichen Träger zu suchen, wurde ein solcher angenommen und Phlogiston genannt. Wie bekannt, ist diese Lehre von J. J. Becher vorbereitet, von G. E. Stahl (1660 bis 1734) in allen ihren Zusammenhängen entwickelt worden, wodurch zum ersten Male ein rationelles System geschaffen wurde, das einen grossen Teil der damals wichtigsten Stoffe zusammenfasste und ordnete.
Es ist gegenwärtig noch oft üblich, die Phlogistontheorie als einen unverständlichen Unsinn anzusehen, wenn sich auch dieser landläufigen Ansicht gegenüber bereits wichtige Stimmen geäussert haben, welche auf die grosse Bedeutung dieser Theorie hingewiesen haben. Zwar ist die gelegentlich ausgesprochene Idee, dass man im Phlogiston einen Vorläufer des Energiebegriffes zu erkennen habe, als zu weitgehend abzulehnen; doch hat diese Theorie die überaus wichtigen Begriffe der Oxydation und Reduktion in ihrer gegenseitigen Beziehung zum ersten Male klargestellt und dadurch dauernd für die Wissenschaft erobert. Es war von verhältnismässig geringer Bedeutung, dass die stoffliche Auffassung, die ja damals überhaupt noch recht unbestimmt war, zunächst nach der verkehrten Seite gelenkt wurde. Durch die tägliche Beobachtung des Verschwindens von brennendem Holz, Öl u. dergl. war die Vorstellung, dass beim Verbrennen etwas fortgeht, auch erfahrungsmässig die näherliegende. Das Wesentliche ist die Erkenntnis, dass es sich hier um allgemeine und gegensätzliche Vorgänge, Verbrennung und Wiederherstellung oder Oxydation und Reduktion handelt, und diese Erkenntnis ist in der Phlogistontheorie auf das glücklichste zum Ausdrucke gebracht. Dass dies auch von den Zeitgenossen so aufgefasst wurde, ergibt sich aus der Tatsache, dass die beiden Entdecker des Sauerstoffs, Scheele und Priestley, welche beide ganz und gar experimentelle Forscher waren, ihr Leben lang der Phlogistontheorie anhingen, in dieser also einen sie vollständig befriedigenden Führer für ihre experimentellen Arbeiten gefunden hatten.
Erst als bei der weiteren Entwicklung der Wissenschaft auch die Gewichtsverhältnisse der sich gegenseitig umwandelnden Stoffe untersucht wurden, ergab sich eine grosse Schwierigkeit für die Phlogistontheorie. In dieser war angenommen worden, dass die Metallkalke die einfacheren Stoffe seien und durch ihre Verbindung mit Phlogiston in die Metalle übergehen; werden diese ihrer Phlogistons wieder beraubt, so verwandeln sie sich in die Kalke zurück. Nun stellte sich aber heraus, dass die Metallkalke mehr wiegen, als die Metalle, aus denen man sie erhalten hat. Dies war schon vor 1669 von Mayow festgestellt und auf die Verbindung der Metalle mit einem »Spiritus nitro-aereus« oder einem aus Salpeter erhältlichen Gase gedeutet worden, doch waren die Versuche und Betrachtungen dieses jung gestorbenen Forschers unbeachtet geblieben. Nachdem Scheele und Priestley den Sauerstoff hergestellt und seine Eigenschaften beschrieben hatten, konnte gegen Ende des achtzehnten Jahrhunderts Lavoisier die nötige Umkehrung des Grundgedanken der Phlogistontheorie vornehmen und die Verkalkung als Verbindung mit Sauerstoff, die Metallisierung als Verlust des Sauerstoffs deuten. Ebenso zeigte Lavoisier, dass auch bei der Verbrennung nichtmetallischer Stoffe, wie Schwefel und Phosphor, eine Gewichtsvermehrung eintritt und konnte damit die Allgemeinheit seiner Verbrennungstheorie nachweisen.
So erheblich dieser Fortschritt genannt werden muss, so hat man doch seine Bedeutung meist übertrieben. Denn das eigentlich Wesentliche, die Systematik der Verbrennungsreaktionen war bereits durch die Phlogistontheorie geleistet worden, und es war jetzt nur nötig, die Betrachtungen einfach symmetrisch umzukehren, soweit sie sich auf die Auffassung von Zusammensetzung und Zerlegung bezogen. Allerdings erfordert es ein beträchtliches Mass von geistiger Freiheit, die Möglichkeit einer solchen Umkehrung einer gewohnten Anschauung gegenüber zu erkennen, und diesen Ruhm hat Lavoisier reichlich verdient. Ausserdem hat er im Verein mit einigen Zeit- und Fachgenossen alsbald eine der neuen Auffassung entsprechenden Systematik und Nomenklatur ausgearbeitet und durch seinen methodischen Scharfsinn sehr zur schnellen Verbreitung derselben beigetragen.
Lavoisiers Tabelle der chemischen Elemente hat zwar mit der heutigen im ganzen grosse Ähnlichkeit (abgesehen natürlich von den inzwischen entdeckten neuen Elementen), sie enthält aber als Überrest der älteren Anschauungen ausser den wägbaren Elementen an ihrer Spitze noch die »unwägbaren Elemente«, den Wärmestoff und den Lichtstoff. So betrachtete Lavoisier z. B. den Sauerstoff, wie wir ihn als Gas kennen, nicht eigentlich als das Element, sondern als eine Verbindung des elementaren Sauerstoffs mit dem Wärmestoff, wie er denn alle Gase als Verbindungen einfacherer Substanzen mit dem Wärmestoff ansah.
Diese Ansichten sind inzwischen verlassen worden, doch enthalten sie einen sehr beachtenswerten Bestandteil von höchst modernem Charakter, nämlich die Berücksichtigung der vorhandenen Energieverhältnisse. Da alle Stoffe, wenn sie in Gasgestalt übergehen, dabei eine beträchtliche Menge Energie aufnehmen müssen, so ist es sachgemäss, auf diese regelmässige Tatsache irgendwie hinzuweisen; die heutige Chemie hat in ihren Formelzeichen noch kein einfaches Mittel für solche Zwecke entwickelt.
Sehr bemerkenswert ist hierbei eine psychologische Erscheinung, die sich trotz ihrer unerwarteten Beschaffenheit als eine ganz allgemeine Eigentümlichkeit bei erheblichen Fortschritten der Wissenschaft nachweisen lässt. Lavoisier war zu der Aufstellung seiner Verbrennungstheorie durch die Berücksichtigung der Gewichtsverhältnisse geführt worden. Wenn er auch nicht als der unbedingt Erste das Gesetz von der Erhaltung des Gewichtes aufgestellt hat, demzufolge durch keinen physikalischen oder chemischen Vorgang das Gewicht eines abgeschlossenen, d. h. gegen Zutritt fremder und Verlust eigener wägbarer Stoffe geschützten Gebildes geändert werden kann, so ist er doch der, welcher die ausserordentliche Bedeutung dieses Gesetzes für die Beurteilung chemischer Verhältnisse klar erkannt hat; beruht doch seine ganze Bekämpfung der Phlogistontheorie auf der Unvereinbarkeit dieser Theorie mit jenem Gesetze. Anderseits beruht Lavoisiers Begriff des chemischen Elements ganz und gar auf der Anwendung des gleichen Gesetzes: ein Element ist ein Stoff, der nicht in einfachere Stoffe zerlegt werden kann. Wie aber erkennt man, dass ein Stoff B, den man durch chemische Prozesse aus einem Stoffe A erhalten kann, einfacher oder zusammengesetzter ist, als dieser? Eben nur dadurch, dass ein einfacher Stoff nur solche chemische Produkte geben kann, die mehr wiegen, als er, während jedes der Produkte aus einem zusammengesetzten Stoffe weniger wiegt, wenn es einfacher ist. Wenn A bei allen Umwandlungen sein Gewicht vermehrt, so ist es ein Element. Also gehört das Gewicht durchaus zum Begriffe eines Elements. Und dennoch führt der Schöpfer dieses Begriffes neben den wägbaren Elementen unwägbare ein und bringt sich so selbst in einen unmittelbaren Widerspruch mit seiner eigenen Gedankenbildung!
So wunderlich, ja unmöglich derartiges aussieht so ist es doch eine immer wiederkehrende Erscheinung. Es zeigt sich immer wieder, und wir werden später noch einige Male Gelegenheit haben, diese Beobachtung zu wiederholen, dass gerade der aller letzte Schritt, durch welchen der neue Gedanke zur vollständigen Abrundung und zum vollständigen Gegensatz gegen den alten Gedanken gelangen würde, von dem Schöpfer dieses neuen Gedankens meist vergessen, übersehen oder vernachlässigt wird. Es sieht so aus, als wäre die Anstrengung bei der ersten Ausarbeitung eines solchen neuen Gedankens so gross, dass der Erzeuger keine Kraft mehr übrig behält, um auch noch die letzten Unebenheiten und Anhängsel fortzunehmen, und so bleibt gerade aus dem Gedankenkreise, der durch den neuen Fortschritt beseitigt werden soll, Überreste nach, von denen man später nicht verstehen kann, wie sie der grosse Reformator hat übersehen können.
Als einen solchen Überrest aus der durch Lavoisier überwundenen qualitativen Elementenlehre hat man also dies atavistische Auftreten der unwägbaren Elemente in Lavoisiers Tabelle anzusehen. Diese haben dann weiter ihr theoretisches Dasein bis in das neunzehnte Jahrhundert, z. B. in den ersten Auflagen des Handbuches der Chemie von Gmelin, gefristet. Beseitigt hat diese Reste stillschweigend aber endgültig J. J. Berzelius, der sie in seinem System nicht unterbringen konnte, weil ihnen keine Atom- oder Verbindungsgewichte zukommen. Doch hierdurch werden wir in eine Gedankenreihe geführt, die uns erst bei späterer Gelegenheit zu beschäftigen hat.
Im übrigen ist durch Lavoisier derjenige Begriff des chemischen Elements eingeführt worden, der seitdem über ein Jahrhundert unverändert geherrscht hat. Wenn wir uns auf den rein erfahrungsmässigen Standpunkt stellen, so ist hiernach ein Element als ein solcher Stoff bestimmt, der bei allen chemischen Änderungen, die er erfahren mag, sein Gewicht stets vermehrt. Wenn man vorsichtig sein will, so kann man hinzufügen: oder unverändert beibehält. Hiermit sind auch die allotropen Zustandsänderungen der Elemente, z. B. die Umwandlung des weissen Phosphors in roten, gedeckt.
Die bemerkenswerteste Eigentümlichkeit dieser Definition ist, dass sie keine absolute Kennzeichnung eines Elements gibt, denn wenn auch bisher für einen Stoff nur chemische Umwandlungen unter Gewichtsvermehrung oder Verbindung bekannt gewesen sind, so ist dadurch nicht ausgeschlossen, dass neue Hilfsmittel auch eine Umwandlung unter Bildung eines weniger wiegenden Produktes (neben einem oder mehreren anderen Produkten) oder Zerlegung ergeben könnten. So hat Lavoisier sowohl die Alkalien wie die Metalle als vorläufige Elemente angesehen, deren künftige Zerlegung er für wahrscheinlich hielt. Bei den Alkalien hat sich diese Vermutung bald bestätigt, bei den Metallen dagegen nicht. –
Auf einem anderen Wege gelangt man zu einer Definition der Elemente, wenn man die vorher abgebrochene Gedankenreihe durchführt, welche auf dem Unterschiede zwischen einem reinen Stoffe und einer Lösung beruht. Hier sind es wesentlich Arbeiten der neueren Zeit, durch welche die erforderlichen Begriffe festgestellt worden sind.
Der Hauptbegriff, der hier in Anwendung kommt, ist der der Phase. Unter einer Phase versteht man einen solchen Anteil eines körperlichen Gebildes, der überall gleiche spezifische Eigenschaften hat. Der Begriff der Phase fasst somit den des reinen Stoffes und den der Lösung zusammen. Eine gesättigte Salzlösung, auf deren Boden sich ungelöstes Salz befindet, ist beispielsweise ein Gebilde aus zwei Phasen: die Lösung ist die eine, und das feste Salz die andere. Hierbei ist es gleichgültig, ob die Phase eine zusammenhängende Masse bildet oder aus beliebig vielen Teilchen, Körnern oder Tropfen besteht; jeder Teil, in welchem man dieselben Eigenschaften antrifft, gehört zu derselben Phase. Deshalb besteht Wasser, in welchem Eisstücke schwimmen, aus zwei Phasen. Der Chemiker wird geneigt sein, den Unterschied zu übersehen, da Wasser und Eis »derselbe« Stoff sind. Doch hat das Eis eine andere Dichte, als das flüssige Wasser, es hat eine andere Formart, eine andere spezifische Wärme usw., es muss also gemäss der oben gegebenen Definition als eine andere Phase angesehen werden. Dagegen stellt ein Glas Tee mit Rum, das der Chemiker als ein sehr zusammengesetztes Gebilde ansieht, nur eine einzige Phase dar, denn diese Flüssigkeit besitzt (vorausgesetzt, dass man sie gut umgerührt hat) überall die gleichen Eigenschaften.
Der Begriff der Phase, dessen Einführung wir Willard Gibbs (1839 bis 1902) verdanken, gibt uns nun das Mittel, den Unterschied zwischen einem reinen Stoffe und einer Lösung ganz unabhängig von allen Vorstellungen über chemische Verbindungen und Zersetzungen zu definieren. Im allgemeinen können wir nämlich durch Änderung von Druck oder Temperatur bewirken, dass eine gegebene Phase eine andere zu bilden beginnt. So können wir Wasser durch Erniedrigung der Temperatur zur Eisbildung veranlassen, durch Verminderung des Druckes zur Dampfbildung, und beobachten in beiden Fällen die Entstehung einer neuen Phase. Es gibt nun im allgemeinen je ein ganz bestimmtes Wertpaar von Druck und Temperatur, bei welchen diese zweite Phase neben der ersten bestehen kann, wie der Erstarrungspunkt oder Siedepunkt des Wassers bei Atmosphärendruck. Durch Zu- oder Abführung von Wärme sowie durch Veränderung des Volumens kann man nun die frühere Phase allmählich in die neue überführen. Hierbei sind zwei Fälle möglich. Entweder die Überführung gelingt vollständig unter konstanten Umständen von Druck und Temperatur, oder wir müssen eine dieser Grössen beständig ändern, während wir die Umwandlung bewerkstelligen. Eine Phase der ersten Art nennen wir einen reinen Stoff, eine solche der zweiten nennen wir eine Lösung. So geht reines Wasser bei konstanter Temperatur, nämlich 0°, in Eis über (wobei der Druck gleichfalls konstant bleiben muss), während Meerwasser immer mehr und mehr abgekühlt werden muss, wenn eine zunehmende Ausscheidung von Eis bewerkstelligt werden soll. Ebenso bleibt der Siedepunkt (z. B. unter Atmosphärendruck) von reinem Wasser konstant bis zum Versieden des letzten Tropfens, während der des Seewassers um so höher steigt, je mehr Wasser bereits verdampft ist. Hiermit ist ein anderer, wichtiger Umstand verbunden. Der Rückstand vom teilweisen Versieden reinen Wassers hat dieselben Eigenschaften beibehalten, die der ursprüngliche Stoff besass, denn er hat ja z. B. nach der Definition seinen Siedepunkt nicht geändert. Deshalb ist auch das, was als Dampf fortgegangen ist, nach dem Verdichten gleichfalls reines Wasser mit denselben Eigenschaften, denn wenn ein anderer Stoff fortgegangen wäre, könnte der Rückstand nicht unverändert geblieben sein. Solche Phasenumwandlungen, die durchgeführt werden können, ohne dass der Rückstand und die neue Phase ihre Eigenschaften verändern, nennt man hylotrop. Reine Stoffe sind durch hylotrope Umwandlungen gekennzeichnet, Lösungen zeigen dagegen keine hylotrope Umwandlung.
Nun ist es zweitens eine allgemeine Erfahrung, dass Lösungen sich dadurch, dass man sie teilweise in andere Phasen verwandelt und diese nach der Abtrennung in gleicher Weise behandelt, schliesslich in zwei oder mehr reine Stoffe überführen lassen. Man nennt dies Verfahren je nach der Art der Phasen, die hierbei in Betracht kommen, gebrochene Destillation, bezw. Kristallisation, und es ist wohlbekannt, dass alle chemischen Trennungs- und Reinigungsoperationen auf solche Phasentrennungen herauskommen. Denkt man alle Körper, die man in der Natur findet, zunächst, soweit sie mechanische Gemenge sind, nach ihren Eigenschaften in die vorhandenen gleichteiligen oder homogenen Phasen getrennt, und diese Phasen, sofern sie Lösungen sind, in die entsprechenden reinen Stoffe (ihre »Bestandteile«) geschieden, so hat man schliesslich lauter reine Stoffe vor sich.
Ein reiner Stoff bleibt aber nicht bei allen Drucken und Temperaturen ein solcher. Quecksilberoxyd hat z. B. unter gewöhnlichen Umständen alle Eigenschaften eines reinen Stoffes; erhitzt man es aber auf 400°, so verwandelt es sich in ein Gas, das sich wie eine Lösung verhält: beim Abkühlen scheidet es flüssiges Quecksilber aus, und es bleibt gasförmiger Sauerstoff übrig, d. h. aus der homogenen Gasphase werden unter stetiger Veränderung des Gasrückstandes zwei, eine flüssige und eine gasförmige. Diese Umwandlung ist also nicht hylotrop. So ist also Quecksilberoxyd ein Körper, der sich je nach Temperatur und Druck wie ein reiner Stoff oder wie eine Lösung verhält. Da eine jede Lösung immer in mindestens zwei Bestandteile geschieden werden kann, so nennt man in etwas übertragener Bedeutung einen solchen reinen Stoff, der unter bestimmten Umständen in eine Lösung übergeht, einen zusammengesetzten Stoff.
An den erhaltenen Bestandteilen, dem Quecksilber wie dem Sauerstoff, kann man wieder versuchen, ob man durch passende Änderung von Druck und Temperatur diese reinen Stoffe in Lösungen verwandeln kann. Dies gelingt bei beiden nicht; man nennt sie daher Elemente. Hier gelangen wir zu einer neuen Definition der Elemente: sie sind solche Stoffe, die bei allen Änderungen des Druckes oder der Temperatur nur hylotrope Umwandlungen zeigen.
Nun gibt es ausser Druck und Temperatur noch andere Faktoren, durch welche chemische Vorgänge hervorgerufen werden; ganz allgemein bewirkt Energiezu- und -abfuhr in irgendwelcher Gestalt in geeigneten Fällen derartige Umwandlungen von reinen Stoffen in Lösungen oder Gemenge. Wir müssen also die Definition dahin erweitern; Elemente sind solche reine Stoffe, welche unter allen Energiebeeinflussungen nur hylotrope Umwandlungen erfahren.
Beide Definitionen kommen, wie aus den obigen Darlegungen hervorgeht, praktisch auf dasselbe hinaus. Die zweite ist aber viel allgemeiner und unabhängiger von stillschweigenden Voraussetzungen. Denn die Frage, ob aus irgendeinem Stoff ein anderer entstanden ist, muss bei der ersten Definition beantwortet werden, und eine klare Antwort kann ohne die Feststellung des begrifflichen Unterschiedes zwischen reinem Stoff und Lösung gar nicht gegeben werden. So zeigt sich auch in dieser Entwicklung wie in jeder anderen, die wir in der Geschichte der Wissenschaft antreffen, die allgemeine Gültigkeit des Erfahrungssatzes: auf das Einfachste kommt man immer erst zuletzt.
Während die eben betrachteten Verschiedenheiten nur solche formaler oder methodischer Natur sind und sachliche Änderungen des Elementenbegriffs nicht erfordern, ist in neuester Zeit eine Entdeckung gemacht worden, welche eine tiefgehende Umwälzung an dieser scheinbar sichersten und ruhigsten Stelle der Wissenschaft bedingen wird. Sie hängt mit dem wunderbaren Stoffe Radium zusammen, dessen Entdeckung durch das Ehepaar Curie den Ausgangspunkt für ein ganz neues Kapitel der Wissenschaft gebildet hat. Radium ist ein Element, ähnlich dem Baryum und bildet ganz ähnliche Verbindungen wie dieses. Auch widersteht es allen Versuchen, es zu zerlegen und verhält sich bezüglich aller gewöhnlicher Eigenschaften so vollkommen den anderen Elementen ähnlich, dass man ihm in der Tabelle der chemischen Elemente einen ganz bestimmten Platz hat anweisen können, der bis zu seiner Entdeckung offen gelassen war, weil man mit Bestimmtheit erwartete, dass ein entsprechendes Element früher oder später entdeckt werden würde.
Nur in einer Hauptsache verhält sich das Radium und alle seine Verbindungen wesentlich anders, als die anderen Elemente. Es verletzt anscheinend beständig das Gesetz von der Erhaltung der Energie, denn es entwickelt unaufhörlich Energien verschiedener Art. Insbesondere sendet es eigentümliche Strahlen aus, welche die photographische Platte verändern und die Luft elektrisch leitend machen; ausserdem entwickelt es beständig Wärme, so dass seine Temperatur dauernd höher ist, als die seiner Umgebung. So drohte die Existenz dieses Stoffes das Grundgesetz der Naturwissenschaften umzuwerfen und man konnte sich eine Zukunft träumen, wo ein aus Radiumziegeln gebauter Ofen unaufhörlich und unverbraucht unsere Zimmer heizen und vielleicht gar unsere Maschinen treiben könnte. Dass wegen der Seltenheit des Radiums die aus diesem zu gewinnende Energie zunächst viel zu teuer ausfallen müsste, imponiert dem modernen Techniker nicht als Hindernis; er sucht dann eben nach neuen Quellen des Radiums, die eine wohlfeilere Gewinnung gestatten.
Das Rätsel fand schliesslich eine Lösung, oder genauer den Anfang einer Lösung, welche das eine Fundamentalgesetz zu retten gestattete, aber allerdings nur unter Opferung eines anderen Gesetzes von fast gleicher Allgemeinheit. Offenbar konnte nämlich das Energiegesetz aufrecht erhalten werden, wenn man nachweisen konnte, dass das Radium durch die beständige Bildung und Aussendung von Energie eine proportionale Veränderung erleidet. Dass eine Zustandsänderung ganz allgemein mit einer Änderung der Energie verbunden ist, ist ja eine tägliche Erfahrung. Nun aber verlor das Radium trotz seiner beständigen Tätigkeit nichts an Gewicht und änderte auch seine Eigenschaften, insbesondere seine Ausstrahlungsfähigkeit für diese Energien, nicht in messbarer Weise. Dieser Ausweg schien daher verschlossen.
Da entdeckte William Ramsay, dass in einer zugeschmolzenen Glasröhre, die eine Kleinigkeit einer Radiumverbindung enthielt, sich nach einiger Zeit Spuren eines anderen Elements, Helium, zeigten. Das Helium war ihm wohlbekannt, hatte er es doch selbst einige Jahre vorher entdeckt und eingehend studiert. Es hat glücklicherweise die Eigenschaft, schon in sehr kleinen Mengen ein charakteristisches Spektrum mittelst einer elektrischen Entladung zu geben, und so konnte es bereits erkannt werden, als seine Menge noch unwägbar klein war. Immer wieder, wenn das Helium aus der Röhre entfernt worden war, fand es sich nach einiger Zeit wieder ein, so dass nichts übrig blieb als der Schluss, dass hier Radium sich in Helium, ein Element in ein anderes umwandelt.
Hier haben wir also eine wahre Transmutation von ganz derselben Beschaffenheit, wie sie die Alchimisten vergeblich auszuführen gesucht hatten. Das Gesetz von der Erhaltung der Elemente ist somit nicht unter allen Umständen gültig und muss eingeschränkt werden. Ganz überraschend kommt dieser Schluss allerdings nicht denen, welche sich mit der allgemeinen Systematisierung und Klassifikation der Naturgesetze beschäftigt haben. Diesen zeigt sich das Gesetz von der Erhaltung der Elemente als zu einer Gruppe von »Erhaltungsgesetzen« gehörig, aus welcher bereits andere Glieder sich als nicht unerschütterlich erwiesen haben. Die Grössen Es sind dies die Kapäzitätsgrössen der verschiedenen Energiearten., von denen diese Gesetze handeln, pflegen sich allerdings bei den meisten Vorgängen zu erhalten, doch sind überall Ausnahmen teils nachgewiesen, teils wahrscheinlich, die auf ein noch allgemeineres Transformationsgesetz dieser Grössen hindeuten, das allerdings bisher noch nicht aufgefunden und ausgesprochen worden ist.
In neuester Zeit hat Ramsay noch weitere wunderbare Tatsachen festgestellt. Wird das gasförmige Produkt, das aus Radium zunächst entsteht, die »Emanation«, für sich aufbewahrt, so gibt es, wie erwähnt, Helium. Wird es dagegen mit Wasser in Berührung gehalten, so bildet sich ein anderes gasförmiges Element, Neon, und bei Anwesenheit von Kupfer- oder Silbersalzen entsteht ein drittes, Argon. Gleichzeitig finden sich andere, neugebildete Elemente in den Lösungen. Wir stehen hier vor einer fundamentalen Umgestaltung unserer Vorstellung von den bisherigen Elementen.
Ferner liegt noch eine Merkwürdigkeit vor. Wir kennen die chemischen Umwandlungen im allgemeinen jetzt viel genauer, als etwa noch vor zwanzig Jahren; insbesondere sind die Gesetze erforscht, welche die Geschwindigkeit dieser Vorgänge beschreiben. Die Geschwindigkeit, mit welcher das Radium seine Umwandlungen bewerkstelligt, ist aber von ganz anderer Beschaffenheit, als die bisher bekannten. Während diese nämlich höchst veränderlich sind, kennen wir überhaupt noch kein Mittel, die Geschwindigkeit beim Radium zu beeinflussen. Majestätisch wie eine einsame Sonne vollzieht dieses Element seine Umwandlung. Gleichgültig, in welche Verbindung wir es bringen, gleichgültig gegen beliebige Änderungen des Druckes und der Temperatur, gibt es uns eine natürliche oder absolute Zeitkonstante, so dass es uns als eine Uhr dienen könnte, welche keiner Störung irgendwelcher Art ausgesetzt wäre. Allerdings ist dies nur das erste rohe Ergebnis der Beobachtungen, an denen noch zahllose Besonderheiten aufzuklären sind. Aber man sieht aus dieser Betrachtung, welche fundamentale Wendung in der Wissenschaft dieser Fortschritt über den alten Begriff des Elements hinaus bedingen wird.
So schliesst dieser erste Querschnitt durch die Geschichte der Chemie die ältesten wissenschaftlichen Gedankenbildungen mit den neuesten Fortschritten unserer Wissenschaft zusammen und gibt eine lebendige Anschauung von dem organischen Zusammenhange, der alle ihre Teile zu einem grossen Ganzen verbindet.